1、选择题 写出下列反应的离子方程式:
(1)铁与盐酸反应:?
(2)碳酸钠溶液与盐酸混合:?
参考答案:(1)Fe+2H+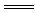 Fe2++H2↑?(2)CO
Fe2++H2↑?(2)CO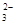 +2H+
+2H+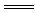 H2O十CO2↑
H2O十CO2↑
本题解析:根据物质的性质结合离子方程式的书写方法书写有关反应的离子方程式。
本题难度:一般
2、选择题 下列离子方程式正确的是( )
A.氯化铵与氢氧化钠两种浓溶液混合加热OH-+NH4+
H2O+NH3↑
B.碳酸氢钠溶液与少量石灰水反应?HCO3-+Ca2++OH-═CaCO3↓+H2O
C.氢氧化镁与稀硫酸反应?H++OH-═H2O
D.单质铜与稀硝酸反应?Cu+2H++2NO3-═Cu2++2NO↑+H2O
参考答案:A.氯化铵与氢氧化钠两种浓溶液混合加热的离子反应为OH-+NH4+?△?.?H2O+NH3↑,故A正确;
B.碳酸氢钠溶液与少量石灰水反应的离子反应为2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故B错误;
C.氢氧化镁与稀硫酸反应的离子反应为2H++Mg(OH)2═2H2O+Mg2+,故C错误;
D.铜与稀硝酸反应的离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D错误;
故选A.
本题解析:
本题难度:简单
3、简答题 请用适当的化学用语填空.
(1)Na2CO3水解的离子方程式:______;
(2)H2S电离方程式:______;
(3)AlCl3水解的离子方程式:______;
(4)在25℃、101kPa下,lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,写出表示甲烷燃烧热的热化学方程式:______;
(5)碱性氢氧燃料电池的两极电极方程式
负极:______;正极:______.
(6)写出NaHCO3溶液中的离子浓度关系
c(H+)+c(Na+)=______;
c(Na+)=______.
参考答案:(1)碳酸钠水溶液中水解,碳酸根离子是多元弱酸阴离子分步水解,水解的离子方程式为:CO32-+H2O?OH-+HCO3-,故答案为:CO32-+H2O?OH-+HCO3-;
(2)硫化氢是弱电解质,在水溶液中存在电离平衡,多元弱酸分步电离,电离的方程式为:H2S?H++HS-,故答案为:H2S?H++HS-;
(3)氯化铝水溶液中铝离子水解生成氢氧化铝和氯化氢,故答案为:Al3++3H2O?Al(OH)3↓+3H+;
(4)lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,16g甲烷燃烧放热889.6KJ,依据热化学方程式书写方法标注聚集状态和对应焓变写出热化学方程式为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol;
(5)氢氧燃料电池原理分析,氢气在负极失电子发生氧化反应,碱性溶液中生成水,负极电极反应为:2H2-4e-+4OH-=4H2O;氧气得到电子生成氢氧根离子,阳极电极反应为:O2+4e-+2H2O=4OH-,
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;
(6)碳酸氢钠溶液中存在电荷守恒为:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-);物料守恒是钠元素和碳元素的守恒,依据化学式可知钠元素和碳元素相同,碳元素的存在形式银碳酸氢根离子水解和电离发生改变,得到物料守恒为c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),
故答案为:c(OH-)+2c(CO32-)+c(HCO3-);c(HCO3-)+c(CO32-)+c(H2CO3).
本题解析:
本题难度:一般
4、选择题 下列离子方程式正确的是
A.向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2—+2H2O
B.向硅酸钠溶液中滴加盐酸制取硅酸:SiO32—+2HCl==H2SiO3↓+2Cl—
C.Ba(OH)2溶液中滴加少量NH4HCO3溶液:NH4++HCO3-+2OH-+Ba2+=NH3·H2O+H2O+BaCO3↓
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH- CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
参考答案:CD
本题解析:略
本题难度:一般
5、选择题 下列离子方程式中正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42—===BaSO4↓+H2O
B.向NaHSO4溶液滴入NaHCO3溶液:HCO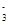 +HSO4-==CO2↑+H2O+SO42—
+HSO4-==CO2↑+H2O+SO42—
C.Na2CO3溶液中通入CO2:CO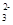 +CO2+H2O===2HCO
+CO2+H2O===2HCO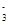
D.CH3COOH溶液与NaOH溶液反应:H++OH-===H2O
参考答案:C
本题解析:A项:违背反应事实,OH-、H+、H2O的化学计量数应为2,故错;B项:HSO4-应拆开,故错;D项:CH3COOH是弱电解质,不能拆开,故错。故选C。
点评:离子方程式正误判断要注意:看原则:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等。可溶的易电离的物质拆成离子。注意过量、少量、适量等。
本题难度:一般