1、填空题 按要求写出对应的离子方程式
(1)写出每步现象对应的离子方程式:向FeCl3溶液中逐滴加入Na2S溶液,先产生淡黄色沉淀,后又产生黑色沉淀:_____________、_____________
(2)向明矾溶液中滴加Ba(OH)2溶液至沉淀物质的量最大:________________
(3)向碳酸氢钡溶液中滴加过量的NaOH溶液:___________________
(4)向含1molFeI2的溶液中通入1.2mol的Cl2:___________________
参考答案:(1)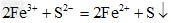 ;?
;?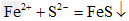 ?
?
(2)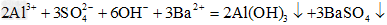 ?
?
(3)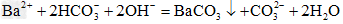
(4)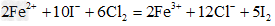
本题解析:
本题难度:一般
2、选择题 下列方程式正确的是
[? ]
A.硫酸与氢氧化钡溶液反应: Ba2+ +OH-+H++SO42- = BaSO4↓+H2O
B.硫酸铜与澄清石灰水反应: Cu2+ +SO42- +C2+ +2OH-=Cu(OH)2↓+CaSO4↓
C.碳酸铵与氢氧化钡溶液反应: Ba2+ +CO32- =BaCO3↓
D.硫酸铵与氢氧化钡溶液共热: 2NH4+ +SO42- +Ba2+ +2OH- =BaCO3↓+2NH3↑+2H2O
参考答案:BD
本题解析:
本题难度:一般
3、选择题 下列现象描述、化学方程式或离子方程式和反应类型都正确的是( )
选项
| 操作方法
| 主要现象
| 化学方程式或离子方程式
| 反应 类型
|
A
| 氢气在氯气中燃烧
| 蓝色 火焰
| H2+Cl2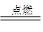 ?2HCl ?2HCl
| 化合 反应
|
B
| SO2通入硝酸
钡溶液中
| 产生白色沉淀
| Ba(NO3)2+SO2+H2O=
BaSO3↓+2HNO3
| 复分解反应
|
C
| 常温下,足量
的Cl2通入
FeBr2溶液中
| 浅绿色变黄色
| 2Fe2++Cl2=2Fe3++2Cl-
| 氧化还原反应
|
D
| 硫化氢通
入碘水中
| 颜色变浅产生
淡黄色固体
| H2S+I2=S↓+2HI
| 氧化还原反应
|
?
参考答案:D
本题解析:氢气在氯气中燃烧产生苍白色火焰,A项错误;硝酸氧化亚硫酸钡生成硫酸钡,B项错误;C项的反应为3Cl2+2FeBr2=2FeCl3+2Br2,C项错误;D项中,碘水的颜色变浅,淡黄色沉淀是单质硫,D项正确。
本题难度:一般
4、选择题 下列离子方程式正确的是?(?)
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2+ + 2OH-+ 2H+ + SO42-= BaSO4↓ + 2H2O
B.向100mL 0.1mol/L FeBr2溶液中通入0.01mol的Cl2:2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
C.AlCl3溶液与过量氨水混合:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.向Mg(HCO3)2中加足量的Ca(OH)2溶液:Ca2+ +2OH-+2HCO3-+2Mg2+=CaCO3↓+MgCO3↓+2H2O
参考答案:C
本题解析:A中生成物还有一水合氨,A不正确;B中亚铁离子的还原性强于溴离子,则氯气首先氧化的是亚铁离子,然后再氧化溴离子。溴化亚铁的物质的量是0.01mol,而氯气只有0.01mol,所以溴离子剩余,B不正确;D中氢氧化钙过量,生成物是碳酸钙、氢氧化镁和水,D不正确,答案选C。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般
5、填空题
以下是原水处理成自来水的工艺流程示意图

(1)原水中含Ca2+、Mg2+、HCO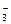 、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_________________________________
、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_________________________________
(2)凝聚剂除去悬浮固体颗粒的过程?(填写编号,多选倒扣)
①只是物理过程?②只是化学过程?③是物理和化学过程FeSO4·7H2O是常用的凝聚剂,它在水中最终生成?沉淀。
(3)通入二氧化碳的目的是?和?。
(4)气体A的作用是?。这种作用是基于气体A和水反应的产物具有?性。
(5)下列物质中,?可以作为气体A的代用品。(填写编号)
①Ca(ClO)2? ②浓氨水? ③K2FeO4? ④SO2
参考答案:(1)HCO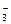 +OH-===CO
+OH-===CO +H2O
+H2O
Mg2++2OH-===Mg(OH)2↓
Ca2++HCO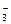 +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
任选其一,其他合理解也给分。
(2)③?胶状Fe(OH)3
(3)除去Ca2+?调节pH
(4)杀菌消毒?强氧化
(5)①③
本题解析:(1)含Ca2+、Mg2+、HCO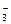 、Cl-的水中加入Ca(OH)2可发生多种反应:HCO
、Cl-的水中加入Ca(OH)2可发生多种反应:HCO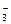 +OH-===CO
+OH-===CO +H2O,Mg2++2OH-===Mg(OH)2↓,Ca2++HCO
+H2O,Mg2++2OH-===Mg(OH)2↓,Ca2++HCO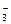 +OH-===CaCO3↓+H2O等等。
+OH-===CaCO3↓+H2O等等。
(2)加入FeSO4·7H2O? Fe2+被氧化为Fe3+,再水解生成胶状Fe(OH)3吸附水中杂质而沉淀。
(3)通入CO2目的,除去剩余Ca(OH)2,即Ca2+和OH-。
(4)气体A应为Cl2,因与水反应生成次氯酸具有强氧化性而杀菌消毒。
(5)应选强氧化剂。
本题难度:简单