1、填空题 用离子方程式表示怎样用化学方法除去下列物质中混有的少量杂质,。
(1)铁粉中混有铝粉??;
(2) FeCl2溶液中混有FeCl3? ??。
??。
参考答案:(1) 2 Al + 2 OH— + 2 H2O ="=2" AlO2 —? + 3 H2 ↑?(2)? Fe + 2Fe3+ ="=" 3 Fe2+
本题解析:略
本题难度:简单
2、选择题 向10mL?0.1mol?L-1?NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x?mL.下列叙述正确的是( )
A.x=10时,溶液中有
、Al3+、,且c()>c(Al3+)
B.x=10时,溶液中有、、,且c()>c()
C.x=30时,溶液中有Ba2+、、OH-,且c(OH-)<c()
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
参考答案:A、当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH-量不足,OH-首先与Al3+反应,与NH4+不反应,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42-也有剩余,但此时不会有AlO2-生成,溶液中c(NH4+)>c(Al3+),故A正确;
B、由A中分析可知,溶液中不会有AlO2-生成,溶液中有NH4+、Al3+、SO42-,参加反应的硫酸根离子为0.001mol,剩余0.001molSO42-,溶液中NH4+未参加反应,但溶液中NH4+水解,故c(NH4+)<c(SO42-),故B错误;
C、当x=30时,0.001?mol的NH4Al(SO4)2与0.003?mol?Ba(OH)2反应,生成0.002?mol?BaSO4、0.001?mol?NaAlO2、0.001?mol?NH3?H2O,且剩余0.001?mol?Ba2+和0.001?mol?OH-,由于NH3?H2O也是一种碱,存在电离平衡:NH3?H2O?NH4++OH-,使得溶液中c(OH-)大于0.001?mol,故c(OH-)>c(AlO2-),故C错误;
D、由C中分析可知,溶液中含有Ba2+、AlO2-、OH-,其中溶液中c(OH-)大于0.001?mol,含有0.001?mol?Ba2+,c(OH-)>c(Ba2+),故D错误;
故选A.
本题解析:
本题难度:简单
3、填空题 (1)根据下列几种粒子的结构示意图,回答问题:
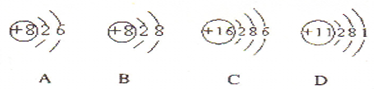
①其中属于阴离子的是______,属于金属元素的是______.(填编号)
②试写出A、C、D三种元素形成的一种化合物在水溶液中的电离方程式______.______
(2)已知氢元素有11H、12H、13H三种核素,氧元素也有816O、817O、818O三种核素,则它们所形成的水分子共有______种.
(3)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
①在该反应中,氧化剂是______,还原剂是______.
②当有0.20mol电子发生转移时,生成氯气的体积为______L(标准状况)
参考答案:(1)①阴离子是质子数小于核外电子数.故B表示阴离子;金属元素原子最外层电子数少于4,故D表示金属元素,故答案为:B;D;
②A、C、D的核内质子数分别为8、16、11,所以三种元素为O、S、Na,形成的化合物为Na2SO4或Na2SO3,均为可溶性的钠盐,是强电解质,电离方程式为:Na2SO4═2Na++SO42- (或Na2SO3═2Na++SO32-),故答案为:Na2SO4═2Na++SO42- (或Na2SO3═2Na++SO32-);
(2)由氧的同位素有16O、17O、18O,氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子,
若水分子中的氢原子相同,
则16O可分别与11H、12H、13H构成水,即存在三种水;
17O可分别与11H、12H、13H构成水,即存在三种水;
18O可分别与11H、12H、13H构成水,即存在三种水;
若水分子中的氢原子不同,
则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
17O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
18O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
?所以共形成3×6=18种水,故答案为:18;
(3)①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,通过化合价升降判断,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,高锰酸钾得电子是氧化剂,HCl失电子是还原剂,故答案为:KMnO4;HCl;
(2)设反应中有0.20mol电子发生转移,生成氯气的体积为x,
? 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O? 转移电子10e-,
? 所以电子与氯气的关系式为10e-~5Cl2
? ?10mol? 5×22.4L?
? 0.20mol? x
? x=2.24L,
? 所以生成气体是2.24L,故答案为:2.24L.
本题解析:
本题难度:简单
4、选择题 下列反应的离子方程式正确的是(?)
A.氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3-
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.盐酸滴入氨水中:H++OH-=H2O
D.碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O
参考答案:B
本题解析:A、SO2+2OH-=SO32-,错误;B、正确;C、H++NH3·H2O=NH4++H2O,错误; D、CaCO3+2H+=Ca2++CO2+H2O,错误。
本题难度:一般
5、选择题 下列离子方程式正确的是
A.lmol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+ HCO3-=CaCO3↓+H2O
C.AlCl3溶液中加入过量氨水:Al3++4 OH-= AlO-2+2H2O
D.向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+= Ag++2NH4++ H2O
参考答案:B
本题解析:A、I-的还原性强于Fe2+,所以氯气不足时先与I-反应,2mol FeI2含有4mol I-,需要1mol氯气,因此亚铁离子不可能参与反应,错误;B、少量小苏打电离生成的HCO3-,完全与澄清石灰水反应,1个HCO3-只需要1个OH-,生成碳酸根离子,再与钙离子结合生成碳酸钙沉淀,正确;C、氢氧化铝沉淀不溶于氨水,错误;D、向银氨溶液中加入足量的盐酸应有氯化银沉淀、氨气生成,错误,答案选B。
本题难度:一般