|
高考化学知识点总结《化学反应速率》答题技巧(2019年最新版)(十)
2020-08-13 06:20:48
【 大 中 小】
|
1、填空题 (7分)将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g) +B(g) 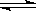 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则: 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用生成物C的浓度增加来表示该反应的速率为: ;
(2)反应前A、B的物质的量浓度分别是: 、 。
(3)10s末,生成物D的浓度为 。
参考答案:(7分)
(1)0.04mol/L·s (2分)(2)1.5 mol/L(1分),0.5 mol/L(1分)
(3)0.4 mol/L(3分)
本题解析:略
本题难度:一般
2、填空题 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g) 2SO3(g)
(1)对于反应2SO2(g)+O2(g) 2SO3(g),化学平衡状态的标志为__________。 2SO3(g),化学平衡状态的标志为__________。
A.SO2减少的化学反应速率和SO3减少的化学反应速率相等
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的分子总数不随时间而变化
D.恒容的容器中气体的密度不随时间而变化
| (2)450℃时,将amol SO2与bmol O2以3:2通入固定容积5L的密闭容器中,
①反应进行至10min时,测得n(SO2) =" 8mol" ,n(SO3) ="4mol" , 则b=_______mol
②10min内平均速率v(SO2)=___________________
③反应达平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时的SO2转化率为___________________.
参考答案:(8分)(1) A B C? (2) ① 8 ?②0.08mol·L-1·min-1?③95%
本题解析:(1)D、根据质量守恒定律得知,气体的总质量不变,容器的体积不变,密度等于质量除以体积,即密度一直不变,故错。故选ABC。
(2)根据化学方程式计算:
2SO2(g)+ O2(g) 2SO3(g) 2SO3(g)
开始的物质的量? amol? b mol? 0 mol
反应的物质的量? 4mol? 2 mol? 4 mol
10min时物质的量? 8mol? (b-2)mol? 4 mol
①amol-4mol=8mol,a=12,b=8。
②v(SO2)=△c(SO2)÷t=△n(SO2)÷V÷t=4mol÷5L÷10min=0.08mol·L-1·min-1。
③设衡时的SO2转化了xmol,根据化学方程式计算:
2SO2(g)+ O2(g) 2SO3(g) 2SO3(g)
开始的物质的量? amol? bmol? 0mol
反应的物质的量? xmol? x/2mol? xmol
10min时物质的量? (a-x)mol? (b-x/2)mol? xmol
根据压强之比等于物质的量之比得:[(a-x)mol+(b-x/2)mol+xmol]/(amol+bmol)=0.715,结合题中信息a:b=3:2,计算得x/a=0.95,故平衡时的SO2转化率为95%。
点评:本题考查化学反应速率、转化率、化学平衡状态的判断、化学平衡的影响因素等,知识面广,应加强平时知识的积累。
本题难度:一般
3、选择题 已知2A(g) 2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是 2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
A.升温 B.增大反应器的体积 C.增大c(A) D.降温
参考答案:B
本题解析:A选项升高温度化学反应速率加快。B选项增大反应器的体积,反应物浓度较少,化学反应速率降低。C选项增大A物质的浓度,正反应速率加快,B物质浓度增大,所以B选项是错误的。D选项,该反应为放热反应,降低温度反应速率减慢,反应向放热反应方向移动所以D选项是错误。所以答案选B。
考点:考查影响化学反应平衡移动的相关知识点。
本题难度:一般
4、计算题 (8分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表: 2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
| n(NO)(mol)
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
(1)NO的平衡浓度c(NO)= 。
(2)用O2表示从0~2s内该反应的平均反应速率v= 。
(3)下图中表示NO2变化的曲线是
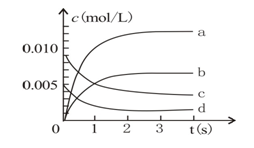
(4)800℃时,容器内起始压强和平衡后压强之比为___________________
参考答案:(8分)⑴3.5×10-3mol·L-1 (2)1.5×10-3mol·L-1·s-1(3)b (4) 3 : 2.35
本题解析:(1)3s时,NO的量不再改变,说明达到平衡状态;
(2)v(NO)=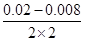 =0.003mol·L-1,则v(O2)=0.0015mol·L-1 =0.003mol·L-1,则v(O2)=0.0015mol·L-1
(3)由题设条件可知平衡时△n(NO)=0.013mol,生成NO2为0.013mol,则其c(NO)=0.0065mol·L-1,结合图像可知NO2变化的曲线为b线
(4)2NO + O2  2NO2 2NO2
始n:0.02 0.01 0
△n:0.013 0.0065 0.013
平n:0.007 0.0035 0.013
在恒容情况下,气体的物质的量比等于压强比,则起始压强和平衡后压强之比为 3 : 2.35
本题难度:困难
5、填空题 (6分)(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择??(填序号)。
①1mL? 0.01 mol·L—1的碘水?②1mL? 0.001 mol·L—1的碘水
③4mL? 0.01 mol·L—1的Na2S2O3溶液?④4mL? 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=?
参考答案:(1)②③④(3分)(各1分,少1扣1,错1全扣)
(2)8.3×10—4mol·L—1·s—1(3分)
本题解析:(1)考查外界条件对反应速率的影响。根据反应的方程式可知,如果选择①,则在④中,Na2S2O3是不足的,碘水是过量的,因此溶液不褪色,正确的答案选②③④。
(2)根据方程式可知,消耗Na2S2O3的物质的量浓度是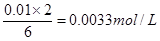 ,所以υ(S2O32—)= ,所以υ(S2O32—)= =8.3×10—4mol·L—1·s—1。 =8.3×10—4mol·L—1·s—1。
本题难度:简单
| 