1、选择题 将固体NH4I置于密闭容器中,在某温度下,发生反应:
NH4I(气) NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气) H2(气)+I2(气)
H2(气)+I2(气)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)= 4mol/L,则NH3的浓度为
A.3.5mol/L
B.4.5mol/L
C.4mol/L
D.5mol/L
参考答案:D
本题解析:由氢气的浓度求算分解的碘化氢的浓度,c(HI)= 4mol/L,为剩余的HI浓度,进而求出第一个反应生成的HI:2HI(气) H2(气)+I2(气)
H2(气)+I2(气)
1mol?L?1?0.5mol?L?1? 0.5mol?L?1
NH4I分解共生成HI:1mol?L?1+4mol?L?1=5mol?L?1
NH4I(气) NH3(气)+HI(气)
NH3(气)+HI(气)
5mol?L?1? 5mol?L?1
NH3的浓度为5mol?L?1,故D项正确。
本题难度:一般
2、填空题 (8分)在一定温度下,有1mol N2和3mol H2发生下列反应:
N2(g)+3H2(g) ?2NH3(g)△H<0。
?2NH3(g)△H<0。
(1)若在相同温度下,分别在1L定压密闭容器A中和1L定容密闭容器B中反应:达到平衡所需的时间t(A)?t(B)(填“大于”“小于”或“等于”,下同)。平衡时是N2的转化率α(A)?α(B)。
(2)若在上述定压密闭容器A中,反应已达到平衡时,再加入0.5 mol氩气,则N2的转化率如何变化?(填“增大”“减小”“不变”,下同)。正反应速度与原平衡相比,有无变化,并简要说明理由?。
参考答案:小于?大于?减小? v(正)减小,等压充入Ar,容器体积变大,反应物浓度减小
本题解析:(1)合成氨的反应是体积减小的、放热的可逆反应。若反应过程中容器体积不变,则压强会减小,而压强小,则反应速率慢。同时压强小反应物的转化率也低。
(2)压强不变,冲入稀有气体,所以容器的体积必须增大,故相当于将原平衡体系的压强降低,反应速率减小,平衡将向逆反应方向移动,反应物的转化率会降低。
本题难度:简单
3、选择题 下图是可逆反应X2 + 3Y2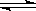 ?2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
?2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
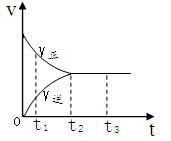
A.t1时,只有正方向反应
B.t2时,反应到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
参考答案:BD
本题解析:A选项,在任何的适合,可逆反应都有正反应方向也有逆反应方向。B选项t2说明该反应达到了平衡的状态,即达到了限度。所以B选项是正确的。C选项,是动态平衡所以C选项是错误的。D选项,当达到平衡后,各物质的浓度保持不变。所以答案选BD
本题难度:一般
4、选择题 在一恒定的容器中充入2molA和1molB发生反应:2A(g)+B(g)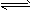 xC(g),达到平衡后,C的体积分数为w%;若维持容器的体积和温度不变,按开始物质的量A:0.6mol、 B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器的体积和温度不变,按开始物质的量A:0.6mol、 B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
[? ]
A.可能为2
B.只能为3
C.可能为2,也可能为3
D.无法确定
参考答案:C
本题解析:
本题难度:一般
5、选择题 处于平衡状态的反应2 H2 S(g)  2H2(g)+S2(g)
2H2(g)+S2(g) 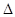 H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,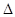 H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
参考答案:B
本题解析:A.加入催化剂,反应途径将发生改变,但是反应的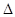 H不会改变。错误。B.升高温度,正逆反应速率都增大,对于可能反应来说,升高温度,根据平衡移动原理:化学平衡向吸热反应方向移动。由于H2S分解反应是吸热反应,所以平衡正向移动,H2S分解率增大。正确。C.该反应是个反应前后气体体积不等的反应。增大压强,化学平衡气体体积减小的反应方向即向向逆反应方向移动。由于正反应为吸热反应,所以平衡逆向移动将会引起体系温度升高。错误。D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小。压强的影响大于浓度增大的影响,根据平衡移动原理:增大压强,化学平衡向褪去体积减小的方向移动你,即向逆反应方向移动。但平衡移动的趋势是很微弱的,平衡移动只能减弱这种改变,但不能消除这种改变,因此H2的浓度不原来还是增大很多。错误。
H不会改变。错误。B.升高温度,正逆反应速率都增大,对于可能反应来说,升高温度,根据平衡移动原理:化学平衡向吸热反应方向移动。由于H2S分解反应是吸热反应,所以平衡正向移动,H2S分解率增大。正确。C.该反应是个反应前后气体体积不等的反应。增大压强,化学平衡气体体积减小的反应方向即向向逆反应方向移动。由于正反应为吸热反应,所以平衡逆向移动将会引起体系温度升高。错误。D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小。压强的影响大于浓度增大的影响,根据平衡移动原理:增大压强,化学平衡向褪去体积减小的方向移动你,即向逆反应方向移动。但平衡移动的趋势是很微弱的,平衡移动只能减弱这种改变,但不能消除这种改变,因此H2的浓度不原来还是增大很多。错误。
本题难度:一般