1、填空题 有若干克某金属,其各原子核内共有3.5×6.02×1023个中子,同质量的该金属和稀硫酸反应共有0.2 mol电子发生转移,生成6.02×1022个阳离子,这些阳离子共有3.0×6.02×1023个质子,则该金属摩尔质量为______________,原子核内有______________个质子,______________个中子,其核组成符号为______________。
参考答案:65 g·mol-1? 30? 35?
本题解析:金属的原子核内有中子3.5 mol,而金属的物质的量n(R)=n(Rx+)=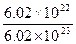 mol="0.1" mol,则金属失电子(0.2 mol)后成二价阳离子,而阳离子有质子3.0 mol,即0.1 mol该金属的原子核有质量数为6.5 mol。M(R)=
mol="0.1" mol,则金属失电子(0.2 mol)后成二价阳离子,而阳离子有质子3.0 mol,即0.1 mol该金属的原子核有质量数为6.5 mol。M(R)=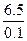 g ·mol-1="65" g·mol-1,元素为Zn。
g ·mol-1="65" g·mol-1,元素为Zn。
本题难度:简单
2、选择题 下列说法正确的是



A.碱金属单质的熔点随原子序数的增大而降低

B.砹位于第七周期第VIIA族,其氢化物的稳定性大于氯化氢

C.硒的最高价氧化物对应水化物的酸性比硫酸强

D.第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
参考答案:A
本题解析:略
本题难度:简单
3、选择题 [2012·课标全国卷] 短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是( )
A.上述四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
参考答案:C
本题解析:元素W、X、Y、Z分别是H、C、O、Ne。H、C、O三种元素原子半径大小为H<O<C,Ne的原子半径与C、O的无可比性,A项错;四种元素原子的核外最外层电子数总和为19,B项错;H与O可形成H2O2,H2O2中既含极性共价键又含非极性共价键,C项正确;C与H组成的化合物是烃,碳原子数较大的烃的沸点可能高于H2O和H2O2的沸点,D项错。
本题难度:一般
4、选择题 已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是(?)
A.原子序数:Y>X>Z>W
B.离子半径: X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>X
D.还原性: X>Y W2-> Z-
参考答案:B
本题解析:A.X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,由于阳离子是原子失去电子形成的,阴离子是原子获得电子形成的。所以原子序数Y>X>Z>W。正确。B.对于电子层结构相同的微粒来说,核电荷数越大,离子半径就越小。因此离子半径: W2- >Z->X+>Y2+ [错误。金属元素的原子失去最外层电子;非金属元素的原子获得电子达到最外层8个电子的稳定结构。所以原子最外层电子数:Z>W>Y>X。正确。D.X、Y是同一周期的元素,原子序数越大,该元素的单质的还原性就越弱。由于原子序数Y>X,所以还原性: X>Y;W、Z是同一周期的非金属元素。元素的非金属性越强,其对应的阴离子的还原性就越弱。非金属性Z>W,所以还原性来W2-> Z-。正确。
本题难度:一般
5、选择题 下列各种性质的比较中.正确的是?(?)
A.分子的稳定性:HF>H2O>NH3
B.熔点:金刚石>汞>硫
C.离子的半径:Cl->Al3+>Na+
D.沸点:AsH3>PH3>NH3
参考答案:A
本题解析:A正确,比较氢化物的稳定性即比较对应元素的非金属性强弱,同周期从左到右元素的非金属性逐渐增强;B错,熔点:金刚石>硫>汞;C错,离子的半径:Cl-> Na+ > Al3+;D错,由于氨分子间存在氢键,所以沸点最高,正确为:沸点:NH3>AsH3>PH3
本题难度:一般