1、选择题 下列的氢氧化物中,碱性最强的是( )
A.Ca(OH)2
B.NaOH
C.RbOH
D.Al(OH)3
参考答案:由元素在周期表中的位置及同主族从上到下元素的金属性增强,同周期从左向右元素的金属性减弱,
则金属性Rb>Ca>Na>Al,
元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,
所以RbOH的碱性最强,
故选C.
本题解析:
本题难度:一般
2、选择题 将甲、乙两种非金属的性质相比较,知道
①甲比乙容易与H2化合
②甲原子能与乙的阴离子发生氧化还原反应
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强
④与某金属反应时甲原子得电子数目比乙的多
⑤甲的单质熔、沸点比乙低能说明甲比乙的非金属性强的是
A.①④
B.③⑤
C.①②③
D.①②③④⑤
参考答案:C
本题解析:非金属性强弱的比较主要从以下几方面进行判断:(1)元素周期律,(2)最高价化合物对应的水化物的酸性来判断,(3)其氢化物的稳定性及化合条件,(4)与盐酸之间的置换反应或物质之间的置换反应,(5)反应的条件、剧烈程度和化合物的价态等等.C项正确.
本题难度:一般
3、简答题 已知A、B、C、D、E为原子序数递增的五种短周期元素,A与C、B与D同主族.E是所在周期原子半径最小的元素,C、D质子数之和是A、B质子数之和的三倍,A元素某种同位素原子不含有中子.请根据以上信息回答:
(1)C2B2的电子式______,A2B2属于______晶体(“分子”、“原子”或“离子”).
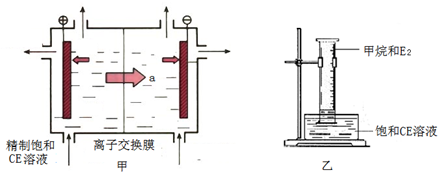
(2)甲装置是离子交换膜法电解饱和CE溶液的原理示意图.透过交换膜的离子a是______,电解的离子方程式______.
(3)为检验E2的性质,某同学做了如下实验:
①Cu丝在E2中燃烧的现象______,你认为Fe丝在E2也可点燃的理由是______.
a.Fe与Cu都是金属元素
b.Fe的熔点比Cu高
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②将乙装置放置在光亮的地方(日光没有直接照射),一段时间后,观察到量筒壁上有油状液滴生成,量筒内气体颜色变浅等.生成的物质有______种,水槽中的液体用饱和CE溶液而不用水的原因是______.
(4)D的单质能跟C的最高价氧化物对应的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式______.
(5)用铂作电极电解1L含有0.4molCuDB4和0.2molCE的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是______.
参考答案:(1)C2B2为过氧化钠,由钠离子与过氧根离子构成,电子数为
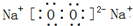
;
A2B2是过氧化氢,属于分子晶体.
故答案为:
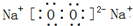
;分子.
(2)CE溶液为氯化钠溶液,左侧连接电源的正极,氯离子放电生成氯气,溶液含有过多的钠离子;右侧连接电源的负极
,氢离子放电生成氢气,溶液中含有过多的氢氧根,为使两侧溶液呈电中性,离子a从左侧透过交换膜到右侧,故离子a是Na+.电解的离子方程式为2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-.
故答案为:Na+;2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-.
(3)①E2是氯气,Cu丝在氯气中燃烧的现象为 产生棕黄色的烟;Cu丝在氯气能燃烧,Fe的金属性比Cu强,Fe丝在氯气中也可点燃燃烧.
故答案为:产生棕黄色的烟;?d.
②E2是氯气,甲烷与氯气在光照条件下发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢5种物质.
水槽中的液体用饱和氯化钠溶液目的是降低Cl2在水中的溶解度,抑制Cl2和水的反应.
故答案为:5;降低Cl2在水中的溶解度,抑制Cl2和水的反应.
(4)D的单质为S,C的最高价氧化物对应的水化物的浓溶液为氢氧化钠溶液,S与氢氧化钠溶液反应生成硫化钠、亚硫酸钠和水,离子方程式为3S+6OH-═2S2-+SO32-+3H2O.
发生氧化还原反应,
(5)CuDB4是硫酸铜,CE是氯化钠,电解含有0.4mol硫酸铜和0.2mol氯化钠的水溶液,阳离子为铜离子放电,阴离子先是氯离子放电生成氯气,氯离子提供的电子的物质的量为0.2mol,由于得到了0.3molCu,转移电子物质的量为0.6mol,所以氢氧根还放电生成氧气,氢氧根提供的电子的物质的量为0.6mol-0.2mol=0.4mol.
? 2Cl--2e-═Cl2↑
0.2mol?0.2mol?0.1mol
4OH--4e-═2H2O+O2↑
?0.4mol?0.1mol
所以生成的气体的体积为(0.1mol+0.1mol)×22.4L/mol=4.48L.
故答案为:4.48L.
本题解析:
本题难度:一般
4、简答题 下列说法正确的是( )
A.门捷列夫编制的第一张元素周期表是按相对原子质量由小到大依次排列的
B.第二周期元素的最高化合价为+1→+7
C.同族元素的最外层电子数一定相同
D.同周期元素的电子层数不一定相同
参考答案:A.1869年门捷列夫编制的第一张元素周期表,是按相对原子质量由小到大依次排列的,故A正确;
B.第二周期元素中O、F没有正价,则元素的最高化合价不会由+1→+7,故B错误;
C.同主族元素的最外层电子数一定相同,零族中He的最外层电子数为2,其余为8,则同族元素的最外层电子数不一定相同,故C错误;
D.同周期元素的电子层数相同,电子层数等于周期数,则同周期元素的电子层数一定相同,故D错误;
故选A.
本题解析:
本题难度:一般
5、选择题 下列叙述不正确的是
A.H2S、H2O、HF的稳定性依次增强
B.RbOH、KOH、Mg(OH)2的碱性依次减弱
C.Na+、Mg2+、Al3+的氧化性依次减弱
D.H4SiO4、H2CO3、H2SO4的酸性依次增强
参考答案:C
本题解析:由非金属性S<O<F,可断定稳定性H2S<H2O<HF,A项叙述正确.由金属性Rb>K>Mg,可断定碱性RbOH>KOH>Mg(OH)2,B项叙述正确.由金属性Na>Mg>Al,可断定氧化性Na+<Mg2+<Al3+,C项叙述错误.非金属性Si<C<S,可断定酸性H2SiO3<H2CO3<H2SO4,D项叙述正确.
本题难度:一般