1、选择题 短周期元素X、Y、Z、W的原子序数依次增大,X?原子的最外层电子数是其内层电子总数的3倍,Y?原子的最外层只有2个电子,Z?单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
A.元素X?的简单气态氢化物的热稳定性比W的强
B.元素W?的最高价氧化物对应水化物的酸性比Z的弱
C.化合物YX、ZX2、WX3?中化学键的类型相同
D.原子半径的大小顺序:rW>rZ>rY>rX
参考答案:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素,
A、非金属性O>S,故元素O的简单气态氢化物的热稳定性比S的强,故A正确;
B、非金属Si<S,故元素S的最高价氧化物对应水化物的酸性比Si的强,故B错误;
C、化合物MgO为离子化合物,含有离子键,SiO2、SO3?属于共价化合物,含有共价键,故C错误;
D、同周期自左而右,原子半径减小,同主族电子层越多原子半径越大,故原子半径Mg>Si>S>O,即rY>rZ>rW>rX,故D错误;
故选A.
本题解析:
本题难度:一般
2、填空题 现有甲、乙两种元素,第3周期元素甲最外层有2个电子,元素乙3p能级上的电子排布方式为

(1)写出甲、乙两元素的符号:甲_______,乙_______。
(2)甲、乙两元素形成的单质加热反应后的产物是_____,其为_______ (填“离子”或“共价”)化合物,它们发生反应的化学方程式为_________________。
参考答案:(1)Mg;S
(2)MgS;离子;Mg+S MgS
MgS
本题解析:
本题难度:一般
3、简答题 A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等且能形成离子化合物,A与B的质子数之和等于C的质子数,A+与?C2-的核外电子数之和等于D+离子的核外电子数,B?原子与?D+离子的核外电子数之和等于?E?原子的核外电子数.
(1)B的元素符号为______,E的原子结构示意图______;由A、C、E三种元素组成的化合物具有漂白性,其电子式为______.
(2)将少量的D2C2投入到Na2S溶液中,产生浑浊现象,则反应的离子方程式为______.
(3)A、B、C三种元素可组成多种化合物,请写出两种水溶液呈酸性的化合物,其中甲物质促进水的电离______,物质乙抑制水的电离______;室温下,若两溶液的pH都为4,则两溶液中水电离的氢离子浓度比为:甲:乙=______
(4)A与B化合形成10电子化合物丙,A与E化合形成18电子化合物丁;常温下,pH=11的丙溶液与pH=3的丁溶液等体积混合后溶液的pH______7(填“>”“<”“=”),溶液中离子浓度由大到小的顺序为______.
(5)A2与C2可构成燃烧电池,若电解质溶液为KOH溶液,该电池的负极反应为______.
参考答案:A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等,则为同族元素,且A、D能形成离子化合物,该族含有金属与非金属,为短周期元素,故为第ⅠA族,结合A、D原子序数可知,A为氢元素,D为钠元素;A+与?C2-的核外电子数之和等于D+离子的核外电子数,则C的质子数为10-2=8,故C为氧元素;A与B的质子数之和等于C的质子数,则B的质子数为8-1=7,故B为氮元素;B?原子与?D+离子的核外电子数之和等于?E?原子的核外电子数,则E的核外电子数为7+10=17,故E为氯元素.
故A为氢元素,B为氮元素;C为氧元素;D为钠元素;E为氯元素.
(1)由上述分析可知,B为N元素;E为氯元素,原子核外有17个电子,有3个电子层,最外层有7个电子,原子结构示意图为
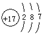
;由A、C、E三种元素组成的化合物具有漂白性,该化合物为HClO,分子中氧原子分别通过1对共用电子对与氢原子、氯原子连接,其电子式为

,
故答案为:N;
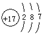
;

;
(2)将少量的Na2O2投入到Na2S溶液中,过氧化钠具有强氧化性,将硫离子氧化为S单质,产生浑浊现象,同时生成氢氧化钠,则反应的离子方程式为 2H2O+S2-+Na2O2═4OH-+S↓+2Na+,
故答案为:2H2O+S2-+Na2O2═4OH-+S↓+2Na+;
(3)A为氢元素,B为氮元素;C为氧元素;A、B、C三种元素可组成多种化合物,水溶液呈酸性的化合物,为酸或强酸弱碱盐,其中甲物质促进水的电离,甲为盐,则甲为NH4NO3,物质乙抑制水的电离,乙为酸,则乙为HNO3;室温下,若两溶液的pH都为4,NH4NO3溶液中氢离子为水电离氢离子,浓度为10-4mol/L,硝酸中水电离的氢离子浓度等于溶液中氢氧根离子浓度,浓度为10-1410-4=10-10mol/L,则两溶液中水电离的氢离子浓度比为甲:乙=10-4mol/L:10-10mol/L=106,
故答案为:NH4NO3;HNO3;106;
(4)A与B化合形成10电子化合物丙为NH3,A与E化合形成18电子化合物丁为HCl,常温下,pH=11的丙溶液中氢氧根离子浓度为10-3mol/L,pH=3的丁溶液中氢离子浓度为10-3mol/L,氨水是弱电解质,电离程度不大,等体积混合后溶液中氨水有剩余,为氯化铵与氨水混合液,剩余氨水浓度远大于氯化铵浓度,一水合氨的电离程度大于铵根离子的水解程度C(NH4+)>C(Cl-),C(OH-)>C(H+),所以溶液的pH>7,溶液中离子浓度由大到小的顺序为C(NH4+)>C(Cl-)>C(OH-)>C(H+),
故答案为:;C(NH4+)>C(Cl-)>C(OH-)>C(H+);
(5)H2与O2构成燃烧电池,若电解质溶液为KOH溶液,负极发生氧化反应,氢气在负极放电,在碱性条件下生成水,该电池的负极反应为 H2+2e-+2OH-=2H2O,
故答案为:H2+2e-+2OH-=2H2O.
本题解析:
本题难度:一般
4、简答题 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,在所有元素中A的原子半径最小,B原子最外层电子数是次外层的2倍.A、E同主族,D、F同主族,且D、F的原子序数之和为A、E的原子序数之和的2倍,请回答下列问题:
(1)写出下列元素的名称:C______;E______;
(2)A、C能形成多种化合物,其中C2A4的结构式为______(用元素符号回答,下同);
(3)化合物E2D2中存在的化学键类型为______;
(4)由A、D、E、F四种元素形成的两种化合物,在水溶液中两者反应的离子方程式为______;
(5)B的单质可与A、D、F形成化合物的浓溶液反应,为检验所有生成物,被检验物质的顺序依次为______.
参考答案:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,在所有元素中A的原子半径最小,则A为氢元素;B原子最外层电子数是次外层的2倍,B有2个电子层,最外层电子数为4,故B为碳元素;A、E同主族,原子序数E等于碳元素,则E为钠元素;D、F同主族,且D、F的原子序数之和为A、E的原子序数之和的2倍,则D、F的原子序数之和为24,故D为氧元素,F为硫元素;原子序数C介于碳元素与氧元素之间,故C为氮元素.
(1)由上述分析可知,C为氮元素;E为钠元素,故答案为:氮;钠;
(2)A为氢元素、C为氮元素,二者形成的C2A4为N2H4的,氮原子之间形成1对共用电子对,氮原子与氢原子之间形成1对共用电子对,结构式为
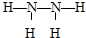
,
故答案为:
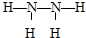
;
(3)D为氧元素、E为钠元素,二者形成化合物E2D2是Na2O2,过氧化钠是离子化合物,钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成非极性键,
故答案为:离子键、非极性键;
(4)A为氢元素、D为氧元素、E为钠元素、F为硫元素,由四种元素形成的两种化合物为NaHSO4、NaHSO3,二者在水溶液中反应的离子方程式为H++HSO3-═H2O+SO2↑,
故答案为:H++HSO3-═H2O+SO2↑;
(5)A为氢元素、B为碳元素、D为氧元素、F为硫元素,B的单质可与A、D、F形成化合物的浓溶液反应,为碳与浓硫酸反应生成H2O、SO2、CO2,检验水用无水硫酸铜,检验二氧化硫用品红试液,检验二氧化碳用澄清石灰水,气体固体品红试液、澄清石灰水会带出水,故最先检验水;二氧化硫与氢氧化钙反应生成亚硫酸钙白色沉淀,与二氧化碳与石灰水反应现象相同,干扰二氧化碳的检验,故检验二氧化碳之前先检验二氧化硫,并除去二氧化硫,最后检验二氧化碳.被检验物质的顺序依次为H2O、SO2、CO2,
故答案为:H2O、SO2、CO2.
本题解析:
本题难度:一般
5、选择题 W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是( )
A.W、X、Y形成的简单离子核外电子数相同
B.Z和W可形成原子个数比为1:2和1:3的共价化合物
C.Y和Z形成的化合物可以通过复分解反应制得
D.X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应
参考答案:A.W、X、Y形成的简单离子分别是O 2-、Na+、Al 3+,其核外电子数都为10,故A正确;
B.S、O可形成原子个数比为1:2和1:3的共价化合物SO2、SO3,故B正确;
C.Y和Z形成的化合物是Al2S3,硫化铝在水溶液能发生剧烈的复分解反应,故C错误;
D.X、Y和Z三种元素形成的最高价氧化物对应的水化物分别是氢氧化钠、氢氧化铝、硫酸,氢氧化铝是两性氢氧化物,与氢氧化钠、硫酸都反应,所以它们之间能两两反应,故D正确;
故选C.
本题解析:
本题难度:一般