1、选择题 向的硫酸中加入100mL18mol/L足量铜片,加热并充分反应。下列有关说法正确的是
A.充分反应后转移1.8mol电子
B.H2SO4只作氧化剂
C.若不加热应生成H2
D.消耗的铜的质量一定少于57.6g
参考答案:D
本题解析:试题分析:18mol/L的硫酸为浓硫酸,铜与浓硫酸反应的化学方程式:
Cu+2H2SO4 CuSO4+SO2
CuSO4+SO2 +2H2O;根据化学方程式,可得等式
+2H2O;根据化学方程式,可得等式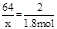
所以消耗的铜的质量为57.6g,但由于随着反应的进行,硫酸的浓度减小,铜不与稀硫酸反应,因此,消耗的铜的质量一定少于57.6g。故答案选D。
考点:铜与硫酸的反应
点评:本题是对铜与浓硫酸反应的考查,需注意的是随着反应的进行,硫酸浓度降低,反应即停止;另一个需要加以区分的是与硝酸的反应,由于硝酸具有氧化性,因此铜与浓硝酸、稀硝酸均发生反应,只是反应产物不一样而已。
本题难度:困难
2、选择题 实验室里钠保存在下列哪种液体中:
A.煤油
B.水
C.汽油
D.四氯化碳
参考答案:A
本题解析:本题能力层次为B。钠的化学性质很活泼,与水、氧气均能发生反应,所以保存时要隔绝空气和水。汽油易挥发、易燃。四氯化碳的密度较大,钠会浮在上面,不能起保护作用。答案是A;
学法指导:选择保存物质的方法时,要熟悉该物质的主要的物理性质(如密度、溶解性、挥发性等)和化学性质(如见光、受热是否稳定,是否容易被氧化或易燃等)。保存物质的方法通常有密封、放在阴凉处、放在煤油里、放在水里、放在棕色试剂瓶里保存等。
本题难度:简单
3、选择题 在无色透明的强酸性溶液中,下列离子组能大量共存的是
A.Na+、K+、OH—、Cl—
B.Ba2+、Na+、CO32—、NO3—
C.Mg2+、Na+、SO42—、Cl—
D.K+、 NH4+、 Cl—、Cu2+
参考答案:C
本题解析:试题分析:解离子共存问题注意:(1)离子之间能反应不能大量共存,反应有四类:①复分解反应:生成气体、沉淀、难电离的物质,②氧化还原反应③相互促进的水解反应④络合反应;(2)注意题目中的隐含条件:颜色、酸碱性等。A、强酸性溶液中H+和OH—生成水,不能大量共存,错误;B、Ba2+和CO32—反应生成BaCO3沉淀,不能大量共存,错误;C、给定离子在题给条件下不反应,能大量共存,正确;D、无色溶液,Cu2+为蓝色,错误。
考点:考查离子大量共存问题。
本题难度:简单
4、选择题 在MgCl2、KCl、K2SO4三种盐的混合溶液中含有0.6mol?K+、0.1mol?Mg2+、0.4mol?Cl-,则该溶液中含SO42-为
A.0.1mol
B.0.2mol
C.0.5mol
D.0.15mol
参考答案:B
本题解析:分析:根据溶液中的阴阳离子的电荷总数相等,即溶液中的阳离子带电的电荷量与阴离子所带电电荷量相等.
解答:溶液中阴离子和阳离子的正负电荷总数相等,即1×n(K+)+2×n( Mg2+)=1×n(Cl-)+2×n(SO42-),
所以1×0.6mo+2×0.1mol=1×0.4mol+2n(SO42-),
解得n(SO42-)=0.2mol,
故选B.
点评:本题考查电荷守恒,溶液中阴离子和阳离子的正负电荷守恒是解决溶液中离子浓度的一种简便方法,注意灵活应用.
本题难度:简单
5、选择题 从生活常识角度考虑,钠元素在自然界中存在的主要形式是
A.Na
B.Na Cl
C.NaOH
D.Na2O
参考答案:B
本题解析:钠属于活泼的金属,以化合态的形式存在,主要是以验的形式存在,所以答案选B。
本题难度:一般