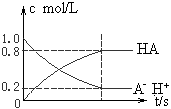1、选择题 现有物质的量浓度均为0.1mol/L的下列5种物质的水溶液:①HNO3②H2SO4③CH3COOH?④NaOH其溶液中由水电离出的c(H+)的大小关系是( )
A.③>①=④>②
B.③=①=④>②
C.②>①>③>④
D.③>①>④>②
2、选择题 下列说法中,错误的是
A.NaHCO3溶液中碳元素主要以HCO3-存在
B.Na2CO3溶液中滴加酚酞呈红色,加热红色变深
C.NH4Cl溶液呈酸性这一事实能说明一水合氨为弱碱
D.在稀醋酸中加醋酸钠固体能促进醋酸的电离
3、选择题 将0.1 mol/L的NH3·H2O溶液加水稀释,下列说法正确的是(? )
A.c(NH)/c(NH3·H2O)比值减小
B.OH-个数将减少
C.c(OH-)/c(NH3·H2O)比值减小
D.NH4+浓度将减小
4、选择题 下列图示与对应的叙述相符的是
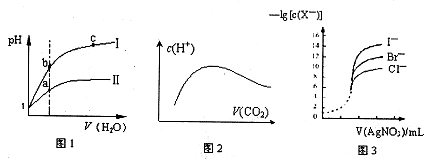
A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系
C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)
D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
5、选择题 一元弱酸HA(aq)中存在下列电离平衡:HA H++A-,如图将1.0mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
H++A-,如图将1.0mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
[? ]
A.
B.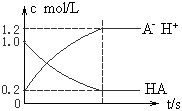
C.
D.