1、选择题 现有物质的量浓度均为0.1mol/L的下列5种物质的水溶液:①HNO3②H2SO4③CH3COOH?④NaOH其溶液中由水电离出的c(H+)的大小关系是( )
A.③>①=④>②
B.③=①=④>②
C.②>①>③>④
D.③>①>④>②
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列说法中,错误的是
A.NaHCO3溶液中碳元素主要以HCO3-存在
B.Na2CO3溶液中滴加酚酞呈红色,加热红色变深
C.NH4Cl溶液呈酸性这一事实能说明一水合氨为弱碱
D.在稀醋酸中加醋酸钠固体能促进醋酸的电离
参考答案:D
本题解析:A.NaHCO3溶液中,HCO3 既电离产生CO3
既电离产生CO3 ,又水解生成H
,又水解生成H CO3,但电离、水解程度都很微弱,所以HCO3
CO3,但电离、水解程度都很微弱,所以HCO3 还是大量存在,碳元素主要以HCO3-存在。不符合条件。
还是大量存在,碳元素主要以HCO3-存在。不符合条件。
B.Na2CO3溶液水解显碱性,所以滴加酚酞会呈红色,加热能促进水解,使溶液碱性增强,红色加深。不符合条件
C.NH4Cl溶液呈酸性,而盐酸为强酸,说明该盐为强酸弱碱盐,能说明一水合氨为弱碱。不符合条件
D.在稀醋酸中加醋酸钠固体,醋酸根离子浓度增大,电离平衡向左移动,抑制了醋酸的电离。符合条件。
故选D
本题难度:一般
3、选择题 将0.1 mol/L的NH3·H2O溶液加水稀释,下列说法正确的是(? )
A.c(NH)/c(NH3·H2O)比值减小
B.OH-个数将减少
C.c(OH-)/c(NH3·H2O)比值减小
D.NH4+浓度将减小
参考答案:D
本题解析:在0.1 mol/L的NH3·H2O溶液中存在电离平衡:NH3·H2O NH4++OH-。当加水稀释时,A. 假如平衡不发生移动c(NH3·H2O)、c(NH4+)的浓度都减小,由于生成物的系数大,稀释的倍数多,所以平衡向电离的方向移动,c(NH3·H2O)比稀释的倍数大,c(NH4+)比稀释的倍数小,所以c(NH4+)/c(NH3·H2O)比值增大。错误。B.加水稀释促进了物质的大量,所以OH-个数将增大。错误。C.加水时c(OH-)、c(NH3·H2O)都减小,因为平衡正向移动,所以c(OH-)减小的倍数小于c(NH3·H2O)减小的不是,因此c(OH-)/c(NH3·H2O)比值增大。错误。D.加水稀释,尽管平衡向电离的方向移动,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,因此NH4+浓度将减小。正确。
NH4++OH-。当加水稀释时,A. 假如平衡不发生移动c(NH3·H2O)、c(NH4+)的浓度都减小,由于生成物的系数大,稀释的倍数多,所以平衡向电离的方向移动,c(NH3·H2O)比稀释的倍数大,c(NH4+)比稀释的倍数小,所以c(NH4+)/c(NH3·H2O)比值增大。错误。B.加水稀释促进了物质的大量,所以OH-个数将增大。错误。C.加水时c(OH-)、c(NH3·H2O)都减小,因为平衡正向移动,所以c(OH-)减小的倍数小于c(NH3·H2O)减小的不是,因此c(OH-)/c(NH3·H2O)比值增大。错误。D.加水稀释,尽管平衡向电离的方向移动,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,因此NH4+浓度将减小。正确。
本题难度:一般
4、选择题 下列图示与对应的叙述相符的是
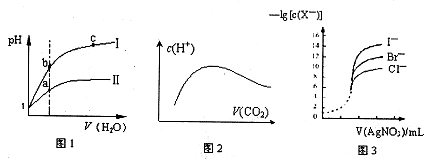
A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系
C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)
D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
参考答案:B
本题解析:A项中,图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释,pH的变化快的曲线是强酸,故曲线I为盐酸,说法错误;B项中,因为酸碱抑制水电离,盐的水解促进水电离,起始的NaOH溶液,水电离的c(H+)小,与CO2反应生成Na2CO3时水解,水电离的c(H+)最大,最后成为饱和的碳酸溶液,水电离出的c(H+)又减小,故图2正确;C项中,图2所示,水电离出c(H+)达到最大值是生成Na2CO3时,溶液中各离子浓度大小分应为c(Na+)>c(CO32-)>c(OH-) >c(HCO3-)>c(H+),故不正确;D项在,用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线可知c(I-)最小,可确定首先沉淀的是I-,说法错误。
本题难度:一般
5、选择题 一元弱酸HA(aq)中存在下列电离平衡:HA H++A-,如图将1.0mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
H++A-,如图将1.0mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
[? ]
A.
B.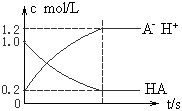
C.
D.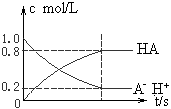
参考答案:C
本题解析:
本题难度:一般