1、选择题 有8 g Na2O2、Na2O、Na2CO3、NaOH的混合物与200 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为(?)
A.8 g
B.15.5 g
C.11.7 g
D.无法计算
参考答案:C
本题解析:n(HCl)=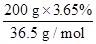 ?=0.2 mol,由题意知,所得溶液中的溶质只有NaCl,根据电荷守恒得:n(Na+)=0.2 mol,则n(NaCl)=0.2 mol,所以蒸干溶液后最终得固体质量为:0.2 mol×58.5 g/mol=11.7 g,故选C项。
?=0.2 mol,由题意知,所得溶液中的溶质只有NaCl,根据电荷守恒得:n(Na+)=0.2 mol,则n(NaCl)=0.2 mol,所以蒸干溶液后最终得固体质量为:0.2 mol×58.5 g/mol=11.7 g,故选C项。
本题难度:一般
2、填空题 A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。
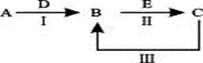
(1)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子。
①写出反应A→B的化学方程式?;
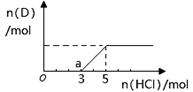
②将一定量的气体D通入2 L C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为?,a点溶液中各离子浓度由大到小的关系是?。
(2)若将(1)中的气体D通入氢氧化钡溶液中得不溶物F,F的KSP=8.1×10-9。现将该沉淀放入0.1mol/L?的BaCl2溶液中,其KSP?,(填:增大、减小或不 变),组成不溶物F的阴离子在溶液中的浓度为?mol/L。
参考答案:(1)2CO2 + 2Na2O2= 2Na2CO3 + O2 (3分)NaOH、Na2CO3 (2分)
c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) (3分)
(2)不变 (2分) ; 8.1×10-8 (2分)
本题解析:由题意结合关系图确定A为过氧化钠,B为碳酸钠,C为氢氧化钠,所以A→B化学方程式为2CO2 + 2Na2O2= 2Na2CO3 + O2;由碳酸钠与盐酸反应的特点Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑两步消耗相同量的盐酸,所以确定图中O点的溶质为NaOH、Na2CO3 ;a 点为3molNaCl和2molNaHCO3,离子浓度大小为? c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) ;Ksp只受温度影响,所以不变,而c(SO42-)=Ksp(BaSO4)/c(Ba2+)=8.1×10-8.
本题难度:一般
3、选择题 化学美表现在很多方面,化学物质的美丽颜色就是其中一个重要的方面。下列物质中,有一种物质的颜色与其他三种的颜色不同,这种物质是
[? ]
A.NaOH?
B.Na2O?
C.Na2O2?
D.NaHCO3
参考答案:C
本题解析:
本题难度:简单
4、选择题 在水玻璃中通入少量的CO2气体,充分反应后加热蒸干,再高温充分灼烧,冷却后所得的固体物质为
A.Na2SiO3
B.Na2SiO3与Na2CO3
C.SiO2与Na2CO3
D.SiO2、Na2SiO3及Na2CO3
参考答案:A
本题解析:略
本题难度:简单
5、计算题 将Na2CO3和NaHCO3的混合物5.48g加热到质量不再减轻时,测得残留固体4.24g。另取一定质量的此混合物固体,跟100mL某浓度的盐酸刚好完全反应,并收集到 672mLCO2气体(标准状况下)求:
(1)此混合物中NaHCO3的质量百分含量;
(2)所用盐酸的物质的量浓度。
参考答案:(1)61.3%;(2)[HCl]=0.4mol/L
本题解析:(1)设混合物中含NaHCO3xg
2NaHCO3 Na2CO3+CO2↑+H2O?质量减少
Na2CO3+CO2↑+H2O?质量减少
2×84? 106? 168-106=62
x? 5.48-4.24=1.24
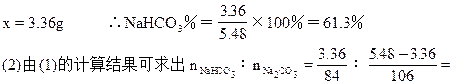
2∶1 则由:
NaHCO3+HCl=NaCl+CO2↑+H2O
2x′? 2x′? 2x′
Na2CO3+2HCl=2NaCl+CO2↑+H2O
x′? 2x′? x′

∴x′=0.01mol
故消耗HCl的总的物质的量为4×0.01=0.04 mol盐酸的物质的量

本题难度:一般