1、选择题 下列关于铯及其化合物的说法不正确的是(? )
A.氢氧化铯是一种强碱,易溶于水
B.铯与水或酸剧烈反应,都能生成氢气
C.碳酸铯用酒精灯加热,可以生成氧化铯和二氧化碳
D.硫酸铯、碳酸铯、硝酸铯都易溶于水
参考答案:C
本题解析:铯是碱金属中最活泼的金属元素,其金属性最强,所以氢氧化铯是强碱且易溶于水;铯单质与水或酸都能剧烈反应放出氢气;碱金属的碳酸盐(正盐)的热稳定性都较好,用酒精灯加热不会发生分解;同钠盐一样,铯盐中的绝大多数也都易溶于水。
本题难度:简单
2、填空题 纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:
一、布兰制碱法。以食盐为原料制碱,该法分三步:
①用氯化钠与硫酸反应制硫酸钠:2NaCl+H2SO4=Na2SO4+2HCl;
②用焦炭还原硫酸钠得硫化钠:Na2SO4+4C=Na2S+4CO↑
③用硫化钠与石灰石反应制碳酸钠:Na2S+CaCO3=Na2CO3+CaS
二、氨碱法即索尔维制碱法。以食盐、氨、二氧化碳为原料,其反应也分三步进行:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3+NH4Cl
③2NaHCO3=Na2CO3+CO2↑+H2O
三、候氏制碱法。低温下先向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,再加入细盐末,因同离子效应,低温氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果往返析出NaHCO3和NH4Cl。该法生产的纯碱质量优良,纯白如雪。
(1)通过三种方法的比较,布兰制碱法工艺的缺点有?(写两点)。
(2)氨碱法工艺的中循环利用的物质是?(填化学式);产品的副产物NH4Cl既可以做氮肥又可以重新生成氨气。写出NH4Cl与生石灰反应的化学方程式?。
(3)候氏制碱法反应的方程式为?。
(4)为什么候氏制碱法工艺中先向饱和食盐水中通入氨气,再通入二氧化碳。理由是?(写两点)。
(5)候氏制碱法产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,用m1表示加热前纯碱样品的质量,m2表示加热后固体的质量。则纯碱中碳酸氢钠的质量分数可表示为:?。
参考答案:(1)生产时需要高温;硫酸对设备腐蚀严重;CaS废弃物长期堆积臭气四溢;成本较高。(4分,答出以上任意两点各2分,其他合理答案均给分)
(2)CO2(1分)?2NH4Cl+CaO 2NH3↑+CaCl2+H2O(2分)
2NH3↑+CaCl2+H2O(2分)
(3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl(2分)
(4)CO2在水中的溶解度较小,吸收率低;后通入CO2保证全部生成NaHCO3(4分,答出以上任意两点各2分,其他合理答案均给分)
(5)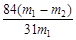 (2分)
(2分)
本题解析:(1)布兰制碱法工艺的缺点有焦炭还原硫酸钠时需要高温;硫酸对设备腐蚀严重;CaS废弃物长期堆积臭气四溢;成本较高等;
(2)从化学方程式中得出氨碱法工艺的中循环利用的物质是CO2;氯化铵与生石灰反应生成氨气、氯化钙、水,化学方程式为2NH4Cl+CaO 2NH3↑+CaCl2+H2O;
2NH3↑+CaCl2+H2O;
(3)候氏制碱法的原理是向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,所以化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl ;
(4)因为二氧化碳在水中的溶解度较小,不易生成碳酸氢钠,所以先通入氨气,使溶液呈碱性,再通入二氧化碳可增大二氧化碳的吸收量从而生产碳酸氢钠;
(5)碳酸氢钠受热易分解,生成碳酸钠、水和二氧化碳,最终该固体为碳酸钠,所以质量减轻(m1-m2)g,每消耗168g碳酸氢钠,固体质量减轻62g,所以固体中碳酸氢钠的质量是168(m1-m2)/62g,所以样品中碳酸氢钠的质量分数是168(m1-m2)/62/m=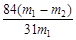 。
。
本题难度:困难
3、选择题 研究外界条件对金属钠和氧气反应的产物的影响采用的方法是
A.分类法
B.观察法
C.实验法
D.推理法
参考答案:C
本题解析:略
本题难度:一般
4、实验题 过氧化钠(Na2O2)是中学常见物质。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,能被过氧化钠氧化生成硫酸钠,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:假设1:反应后固体中只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
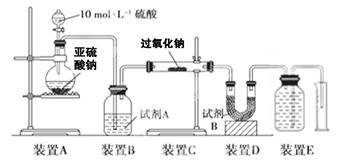
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断, SO2未被氧化时、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
参考答案:(1)Na2SO3(1分)? Na2SO4(1分)?Na2SO3和Na2SO4的混合物(1分)?SO2被部分氧化(1分)
(2)浓H2SO4 (2分)?吸收未反应的SO2(2分)
(3)V=7m1/30 (2分)? V=0? (2分)
(4)SO2+Na2O2= Na2SO4?(2分)
本题解析:根据题目问题:(1)假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;假设3:固体为Na2SO3和Na2SO4的混合物;证明SO2部分被氧化;实验二:(2)过氧化钠和水反应,装置A中试剂能吸收水蒸气,所以试剂为浓硫酸,干燥气体除去水蒸气;装置B为测定生成氧气的体积,需要把剩余的二氧化硫除去,因此试剂B装置作用是吸收未反应的SO2。(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下)。若SO2未被氧化、则发生反应:2Na2O2+2SO2=2Na2SO3+O2。依据化学方程式和反应增重计算E中收集的氧气,即
2Na2O2+2SO2=2Na2SO3+O2?反应增重
1mol? 96g
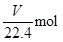 ?m1g
?m1g
解得V=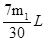 ;若二氧化硫全部被氧化发生的反应为:Na2O2+SO2=Na2SO4;反应过程中无氧气生成,V=0,若0<V<
;若二氧化硫全部被氧化发生的反应为:Na2O2+SO2=Na2SO4;反应过程中无氧气生成,V=0,若0<V<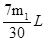 ,则二氧化硫部分被氧化。(4)二氧化硫完全被氧化生成硫酸钠,反应的化学方程式为:SO2+Na2O2═Na2SO4。2和过氧化钠反应的实验探究
,则二氧化硫部分被氧化。(4)二氧化硫完全被氧化生成硫酸钠,反应的化学方程式为:SO2+Na2O2═Na2SO4。2和过氧化钠反应的实验探究
本题难度:一般
5、选择题 能用来鉴别Na2CO3和NaHCO3两种白色固体的方法是(?)
A.分别取少量固体配成溶液,逐滴滴加NaOH溶液
B.分别取少量固体加入到饱和石灰水中
C.分别测定固体的溶解度,溶解度较大的是NaHCO3
D.分别取少量固体配成溶液,再往溶液中逐滴滴加相同浓度的HCl溶液
参考答案:D
本题解析:A、配成溶液,滴加NaOH溶液,反应过程中无明显现象,因此不能鉴别两种物质。
B、加入饱和石灰水中,两者都会产生白色沉淀,因此不能鉴别两种物质。
C、相等温度下,溶解度大的为Na2CO3。
D、配成溶液,逐滴滴加相同浓度的HCl溶液2CO3和NaHCO3的性质
点评:本题主要考查物质的性质与鉴别,属于基础题。熟记物质的基本性质是解答此题的关键。
本题难度:一般