1、选择题 下列物质中,本身所具有的能量最高的是( )
A.氟化氢
B.氯化氢
C.溴化氢
D.碘化氢
参考答案:D
本题解析:
本题难度:一般
2、填空题 A、B、C三种元素均为短周期元素,且原子序数依次增大,三种元素原子序数之和为35,A、C同主族,B+?核外有10个电子,则
(1)A、B、C三种元素分别是______、______、______.
(2)A、B、C之间可形成多种化合物,其中属于离子化合物的化学式分别为______、______、______(任举三种).
(3)用电子式表示B和C形成化合物的过程______.
参考答案:(1)B+?核外有10个电子,根据阳离子的质子数=核外电子数+电荷数,质子数=原子序数,所以B是Na元素;A、B、C三种元素均为短周期元素,且原子序数依次增大,所以C不是第ⅠA元素;A、C同主族,所以A、C的原子序数相差8,设A的原子序数为X,则C的原子序数为X+8,三种元素原子序数之和为35,所以X+11+X+8=35,X=8,所以A是O元素,C是S元素.
故答案为:A是O;B是Na;? C?是 S
(2)A、B、C之间可形成的化合物有硫化钠、氧化钠、过氧化钠、二氧化硫、三氧化硫、硫酸钠、亚硫酸钠等,属于离子化合物的有硫化钠、氧化钠、过氧化钠、硫酸钠、亚硫酸钠等,故答案为:Na2O、Na2S、Na2SO4
(3)B、C形成的化合物是离子化合物,故答案为:

本题解析:
本题难度:简单
3、选择题 氰(CN)2、硫氰(SCN)2、氧氰(OCN)2的化学性质相似,在化学上称为拟卤素。CN-、SCN-、OCN-的性质与卤素离子相似。已知:不同卤素原子能组成卤素互化物,如IBr;HSCN为强酸,HClO、HCN为弱酸。试回答下列各题。
(1)下列物质的电子式错误的是
[? ]
A.IBr 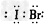
B.HClO 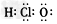
C.CN-
D.MgO 
(2)已知(OCN)2的电子式为: ,则下列SCN-的电子式正确的是
,则下列SCN-的电子式正确的是
[? ]
A.
B.
C.
D.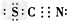
参考答案:(1)B
(2)C
本题解析:
本题难度:简单
4、选择题 下列化合物中既有离子键又有共价键的是( )
A.KBr
B.NH4Cl
C.HF
D.O3
参考答案:B
本题解析:
本题难度:简单
5、填空题 (1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5;C的单质跟盐酸反应,生成C3+和氢气;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构.
①写出元素符号:A______,D______,E______.
②B、C的最高价氧化物对应水化物相互反应的离子方程式为:______.
③写出A2D的电离方程式:______,______.
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质.N、P、AS;O、S、Se分别是VA族、VIA族连续三元素.
①根据元素周期律,预测:酸性强弱H3AsO4______H3PO4.(用“>”或“<”表示)
②元素S的最高正价和最低负价的代数和为______,在一定条件下,S与H2反应有一定限度,请判断:在相同条件下Se与H2反应的限度比S与H2反应限度______.(选填“更大”、“更小”或“相同”)
③将SO2气体通入溴水恰好完全反应后,溶液中存在的离子浓度由大到小的顺序是______.
参考答案:(1)A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子,则A为氢元素;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5,则B为Na、D为S元素;C的单质跟盐酸反应,生成C3+和氢气,则C为Al;E和D能形成E2D型离子化合物,E表现+1价,且E、D两元素的简单离子具有相同电子层结构,则E为K元素,
①由上述分析可知,A为H,D为S,E为K,故答案为:H;S;K;
②B、C的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
③H2S是弱电解质,分步电离,电离方程式为:H2S?HS-+H+、HS-?H++S2-,
故答案为:H2S?HS-+H+、HS-?H++S2-;
(2)①P和As同主族,电子层增多,非金属性As<P,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性H3AsO4<H3PO4,
故答案为:<;
②S位于第ⅥA族,最高价为+6价,最低价为6-8=-2价,故其最高正价和最低负价的代数和=+6-2=4;同主族,从上到下非金属性减弱,与氢气化合越难,在相同条件下Se与H2反应的限度比S与H2反应限度更小,
故答案为:4;小;
③将SO2气体通入溴水中发生反应:SO2+Br2+H2O=2HBr+H2SO4,由于恰好完全反应,为HBr与硫酸混合溶液,二者物质的量浓度之比为2:1,HBr与硫酸都是强电解质,完全电离,溶液呈酸性,故溶液中c(H+)>c(Br+)>c(SO42-)>c(OH-),
故答案为:c(H+)>c(Br+)>c(SO42-)>c(OH-).
本题解析:
本题难度:一般