1、选择题 下列氯化物中不能用金属和氯气直接反应制得的是( )
A.CuCl2
B.FeCl2
C.MgCl2
D.KCl
参考答案:B
本题解析:氯气是一种具有强氧化性的气体,与金属直接反应,可将其氧化至最高价态。因此选项B中的FeCl2不能由氯气与铁直接反应制得。可由金属铁与盐酸或稀硫酸反应制得。故答案选B。
点评:考查氯气的性质,属于基础题,掌握课本中提到的“氯气的强氧化性”即可解答。另外,氯气的考查是本书的重点,复习时,应将其相关性质整合为一个知识系统。
本题难度:简单
2、填空题 漂白粉在社会生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。
(1)2011年3月11日13时46分,日本发生9.0级地震,给地震灾区的人民造成了巨大的生命和财产损失。震灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]中制取漂白粉,化学方程式为_________________。漂白粉的有效成分是__________。
②漂白粉应密封并置于阴暗处保存,请用化学方程式说明其中的原因:_____________、_____________
(2)已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是_________。
①CO2 ②HCl ③H2O ④O2
A.①②③ B.②③④ C.②③ D.①④
参考答案:(1)①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2;②Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
2HClO 2HCl+O2↑
2HCl+O2↑
(2)A
本题解析:
本题难度:一般
3、实验题 请利用下列装置及试剂组装一套装置。
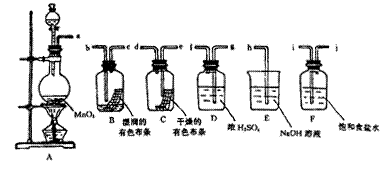
其流程是,先制取纯净干燥的Cl2 (不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(1)按气体从左向右流向将各装置依次连接起来(填字母序号):
a接? ____ _? __?___?接h 。
(2)烧瓶中发生反应的化学方程式是?。
(3)E装置的作用是?,F装置的作用是?。
(4)C瓶中的现象是?,B瓶中的现象是?。以上事实说明起漂白作用的物质是?。
参考答案:(1)ijgfedbc(2分)(2)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(3)吸收多余的氯气防止污染空气(1分)?除去Cl2中HCl气体(1分)
(4)有色布条不褪色?有色布条褪色?次氯酸(HClO)(每空1分)
本题解析:略
本题难度:一般
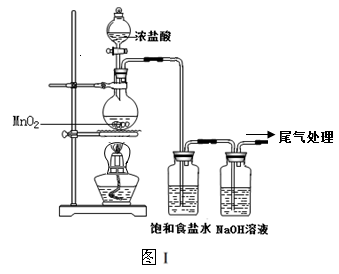
4、实验题 某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。
 ?
?
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是?。
(2)饱和食盐水的作用是?。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H2O(l)?H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)?H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议:?。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是?。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是?。
参考答案:(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O(2)除去氯气中的氯化氢
MnCl2+Cl2↑+2H2O(2)除去氯气中的氯化氢
(3)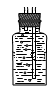 (4)将盛NaOH溶液的洗气瓶浸在冰水中?(5)①b d ②向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
(4)将盛NaOH溶液的洗气瓶浸在冰水中?(5)①b d ②向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
本题解析:(1)烧瓶中反应的化学方程式是MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,注意:①要写有加热符号;②必须为浓盐酸。(2)饱和食盐水的作用是除去氯气中混有的氯化氢气体;饱和氯化钠溶液可以降低氯气的溶解度;饱和氯化钠溶液可吸收氯化氢气体。(4)温度降低可以促进次氯酸钠的生成,所以我们可以将装置浸泡在冰水里。(5)只要能检验出硫酸根离子的存在,就可以证明NaClO氧化了Na2SO3。检验硫酸根离子办法:向混合后的溶液中加入过量盐酸,再加入氯化钡溶液,如果产生白色沉淀就能证明硫酸根离子的存在;向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸,如果还能生成白色沉淀就证明硫酸根离子的存在。②为证明NaClO氧化了酚酞,只要向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
MnCl2+Cl2↑+2H2O,注意:①要写有加热符号;②必须为浓盐酸。(2)饱和食盐水的作用是除去氯气中混有的氯化氢气体;饱和氯化钠溶液可以降低氯气的溶解度;饱和氯化钠溶液可吸收氯化氢气体。(4)温度降低可以促进次氯酸钠的生成,所以我们可以将装置浸泡在冰水里。(5)只要能检验出硫酸根离子的存在,就可以证明NaClO氧化了Na2SO3。检验硫酸根离子办法:向混合后的溶液中加入过量盐酸,再加入氯化钡溶液,如果产生白色沉淀就能证明硫酸根离子的存在;向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸,如果还能生成白色沉淀就证明硫酸根离子的存在。②为证明NaClO氧化了酚酞,只要向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
本题难度:困难
5、实验题 (16分)某学习小组设计了如下图所示的实验方案来探究氯气的性质。
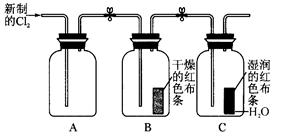
(1)实验时甲同学在A装置中未加入任何试剂,发现B、C中的红色布条均褪色,由此甲同学得出结论:氯气具有漂白性。
实验时乙同学向A装置中加入了某种试剂,发现B中的红色布条不褪色而C中的红色布条褪色,由此乙同学得出结论:氯气没有漂白性。
你认为乙同学向A装置中加入的试剂是 ,甲、乙同学的结论正确的是 。
(2)丙同学思考后认为上面的实验装置存在缺陷,并提出了解决方法。你认为存在的缺陷是 ,解决方法为(用化学方程式表示) 。
(3)丁同学在A装置中加入滴有酚酞的NaOH溶液,观察到A装置中溶液红色逐渐褪去。他提出两种可能原因:①氯气与水反应生成次氯酸,次氯酸具有强氧化性将酚酞氧化使溶液褪色;②氯气与NaOH溶液反应使溶液褪色。请你帮助他设计一个简单的实验验证褪色的原因(简述实验步骤)。
。
参考答案:(1)浓硫酸 乙? (2)无尾气的吸收装置? Cl2+2NaOH===NaCl+NaClO+H2O
(3)向褪色后的溶液中加入NaOH溶液,若观察到溶液变红色,说明褪色的原因为②;若溶液不变红色,说明褪色的原因为①
本题解析:(1)由于氯气是没有漂白性的,起漂白性的是次氯酸。所以应该首先干燥氯气,因此试剂是浓硫酸。由于甲没有干燥氯气,而生成的氯气中含有水蒸气,所以甲的结论是错误的,乙的结论是正确的。
(2)由于氯气有毒,所以必须有尾气处理装置。吸收氯气可用氢氧化钠溶液,方程式为Cl2+2NaOH===NaCl+NaClO+H2O。
(3)如果是由于氯气的氧化而导致褪色,则继续加入氢氧化钠溶液,颜色将不再发生变化。但如果是由于因为中和氢氧化钠而引起的,则继续加入氢氧化钠溶液,溶液会显红色,据此可用验证,即向褪色后的溶液中加入NaOH溶液,若观察到溶液变红色,说明褪色的原因为②;若溶液不变红色,说明褪色的原因为①
本题难度:一般