|
高考化学知识点归纳《物质的量》高频试题巩固(2019年最新版)(四)
2020-08-13 06:57:38
【 大 中 小】
|
1、选择题 某金属氯化物的溶液20mL,物质的量浓度为0.05mol/L,恰好与20mL 0.15mol/L的AgNO3溶液完全反应,则该氯化物的化学式为 ( )
A.RCl
B.RCl2
C.RCl3
D.RCl4
|
参考答案:C
本题解析:RCln的物质的量是20mL*0.05(mol/L)/1000(mL/L)=0.001mol
AgNO3的物质的量是20mL*0.15(mol/L)/1000(mL/L)=0.003mol
假设金属氯化物的化学式为RCln,则发生反应的方程式为:
RCln+ nAgNO3 = R(NO3)n + nAgCl↓
1 n
0.001mol 0.003mol
1*0.003mol=0.001n
解得n=3。
故金属氯化物的化学式为RCl3。
故选C。
考点:物质的量浓度的计算
点评:本题考查的是化学计量在化学方程式中的计算,题目难度不大,注意物质的量与物质的量浓度之间的计算关系。
本题难度:一般
2、选择题 将9.0 g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8 g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是(?)
A.原混合物中铜和铁各0.075mol
B.稀硝酸的物质的量浓度为0.5mol·L-1
C.第一次剩余4.8g金属为铜和铁
D.再加入上述100mL稀硝酸,又得到标准状况下1.12L NO
参考答案:A
本题解析:A、分析题意可知,反应中硝酸与合金正好反应完全,铁转化为二价铁离子。假设n(Cu)=xmol;
n(Fe)=ymol;Cu-2e-=Cu2+;Fe-2e-=Fe2+
依题意有:64x+56y=9(质量关系);2x+2y=0.3(电子得失相等)
x=0.075mol;y=0.075mol,正确;
B、稀硝酸的物质的量浓度为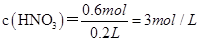 ,错误; ,错误;
C、混合物中各自的质量分别为:m(Fe)=4.2g;m(Cu)=4.8g,因此第一次剩余4.8g金属为铜,错误;
D、再加入100mL稀硝酸,发生如下的反应:
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
由以上方程式可知,生成的气体为三价铁离子物质的量的三分之一:0.0025mol,标况下的体积为:0.056L。错误。
本题难度:一般
3、选择题 将标准状况下的aL HCl(气)溶于1000g水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是
[? ]
A.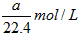
B.
C.
D.
参考答案:D
本题解析:
本题难度:一般
4、填空题 (10分)摩尔质量是指单位物质的量的物质所含有的质量。
(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
(2)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为________。
(4)36g水所含电子的物质的量为________。
(5)配制250 mL 0.2 mol/L NaOH溶液需NaOH质量为________
参考答案:(1)17 g/mo;(2) 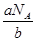 g/mol (3)bNA g/mol ;(4)20mol;(5)2g。 g/mol (3)bNA g/mol ;(4)20mol;(5)2g。
本题解析:(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为17 g/mol;(2)对于同一物质来说,质量越大,物质内的分子个数就越多,设该物质的摩尔质量是M,NA为阿伏加德罗常数,已知a g某气体中含分子数为b,M:a=NA:b,所以M=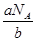 (g/mol),(3)一个铁原子的质量为b g,则NA个铁原子的质量是bNAg,所以Fe的摩尔质量为bNA g/mol; (4)由于水的摩尔质量是18g/mol,所以36g水的物质的量是2mol,一个水分子中含有10个电子,所以2mol的水分子中所含电子的物质的量为20mol;(5)n(NaOH)="C·V=0.25L" ×0.2 mol/L =0.05mol,需NaOH质量为m=n·M=0.05mol×40g/mol=2g。 (g/mol),(3)一个铁原子的质量为b g,则NA个铁原子的质量是bNAg,所以Fe的摩尔质量为bNA g/mol; (4)由于水的摩尔质量是18g/mol,所以36g水的物质的量是2mol,一个水分子中含有10个电子,所以2mol的水分子中所含电子的物质的量为20mol;(5)n(NaOH)="C·V=0.25L" ×0.2 mol/L =0.05mol,需NaOH质量为m=n·M=0.05mol×40g/mol=2g。
考点:考查物质的质量、摩尔质量、微粒数、物质的量浓度的有关计算的知识。
本题难度:一般
5、填空题 将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进行蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示:
组 别
| 1
| 2
| 3
| 盐酸体积(mL)
| 50
| 50
| 50
| A的质量(g)
| 3.80
| 5.70
| 7.60
| 气体体积(mL)
| 896
| 1344
| 1344
|
(1)上表中第 组数据加入的50mL盐酸的反应后有剩余,
(2)试推断:A的成份为
(3)盐酸的物质的量的浓度为 mol·L-1
参考答案:(6分,每空2分) (1)第(1)组 (2)A的成份为 Na2CO3与NaHCO3 (3)1.8
本题解析:(1)①~③组所用盐酸的物质的量相同,而第①组生成的气体比其他两组都少,所以第1组盐酸过量,即故答案选①。
(2)第①组中,n(CO2)=0.896L÷22.4L/mol==0.04mol。
如全部为Na2CO3,则m(Na2CO3)=106g/mol×0.04mol=4.2g
如全部为NaHCO3,则m(NaHCO3)=84g/mol×0.04mol=3.36g,
所以应为Na2CO3与NaHCO3的混合物,故答案为Na2CO3与NaHCO3。
(3)由第②组可知,盐酸和A完全反应,设混合物中含有xmolNa2CO3,ymolNaHCO3,
则106x+84y=5.70、x+y=1.344÷22.4
解得x=y=0.03mol
所以根据元素守恒可知
n(HCl)=n(Na+)=2×n(Na2CO3)+n(NaHCO3)
=2×0.03mol+0.03mol
=0.09mol
所以c(HCl)=0.09mol÷0.05L
=1.8mol/L
考点:考查碳酸钠和碳酸氢钠混合物与盐酸反应得有关判断和计算
点评:该题是中等难度试题的考查,侧重对学生能力的培养。该题的关键是明确反应的原理,然后结合对表中数据的分析,借助于数学中的讨论法进行即可。有利于培养学生的逻辑推理能力和创新思维能力以及数据的分析能力,提高学生的应试能力。
本题难度:困难
|