1、填空题 在 500 mL 2 mol/L NaOH溶液中,NaOH的摩尔质量为 g/mol,溶质的质量是 g,此溶液中含 Na+的物质的量是 mol,Na+的物质的量浓度是 mol/L
参考答案:40 40 1 2
本题解析:n(NaOH)=vc=500×10-3×2=1mol,M(NaOH)=40g·mol-1,m(NaOH)=nM=1mol×40g·mol-1=40g,1molNaOH中含有1mol的Na+,c(Na+)=n/v=1/(500×10-3)=2mol/L。
考点:考查物质的量、物质的量浓度等相关知识。
本题难度:一般
2、选择题 (附加题)设阿伏加德罗常数的值为NA,标准状况下某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是
[? ]
A.? ?
?
B.?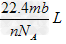 ?
?
C.? ?
?
D.? ?
?
参考答案:A
本题解析:
本题难度:简单
3、选择题 将钾与氧形成的化合物或混合物1.02 g溶于水后,可被0.25 mol/L 盐酸 80 mL恰好中和,则该物质的成分可能是
A.K2O
B.K2O 和K2O2
C.K2O2
D.K2O2和KO2
参考答案:B
本题解析:n(HCl)=0.08L×0.250mol/L=0.02mol,溶液恰好能被80mL浓度为0.25mol/L的HCl溶液中和,
则? K2OX ~2KOH~2HCl
0.01mol? 0.02mol
则K2OX平均摩尔质量M=1.02g/0.01mol=102g/mol,介于K2O(94g/mol)和K2O2(110g/mol)之间,因此,一定条件下钠与氧气反应的生成物是K2O 和K2O2,故选B。
本题难度:一般
4、计算题 地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6mg由高岭石
[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热,在673K~1123K区间内分解为氧化物,样品总失重13.8mg。
⑴方解石的失重百分比为______________ 。
⑵计算矿物中高岭石的质量分数。
参考答案:⑴44%。
⑵解:设66.6mg矿物中高岭石[Al4Si4O10(OH)8]的质量为xmg, 方解石(CaCO3) 的质量为ymg.  依题意:
依题意:
x+y=66.6
72x/516 + 44y/100 =13.8
解得:x=51.6 y=15.0
矿物中高岭石的质量分数
本题解析:
本题难度:一般
5、选择题 3.2g铜与过量的硝酸(8mol/L,30mL)充分反应,硝酸的还原产物是NO和NO2,反应后溶液中含有amolH+,则此时溶液中含有NO3-的物质的量为(?)
A.(0.2+a)mol
B.(0.1+a)mol
C.(0.05+a)mol
D.amol
参考答案:B
本题解析:3.2g铜为0.05mol,最后形成硝酸铜需要结合0.1mol的硝酸根离子,另外溶液中还剩余氢离子a mol,所以硝酸根离子的总量为0.1+a mol。
点评:本题从解题技巧上出发,不需要写出方程式来解答,只需要考虑最后硝酸根离子的存在形态与结合方式就可以求出结果。
本题难度:简单