1、选择题 下列反应既属于氧化还原反应,又是吸收能量的反应是( )
A.利用太阳能电池提供的电能电解水来制氢气和氧气
B.硝酸铵溶于水后,水温降低可达0℃以下
C.氢氧化钡的结晶水合物和氯化铵固体混合反应
D.高温引发铝粉与氧化铁粉末发生铝热反应
参考答案:A.利用太阳能电池提供的电能电解水来制氢气和氧气为吸热反应,H和O元素的化合价发生变化,为氧化还原反应,故A正确;
B.硝酸铵溶于水为物理过程,既不是吸热反应也不是氧化还原反应,故B错误;
C.氢氧化钡的结晶水合物和氯化铵固体混合反应为吸热反应,但不是氧化还原反应,故C错误;
D.铝热反应为放热反应,故D错误.
故选A.
本题解析:
本题难度:简单
2、填空题 实验室制备氯气的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,该反应中氧化剂与还原剂的物质的量之比为______,请将该化学方程式改写为离子方程式______,氯气的工业制法是电解饱和食盐水,请列举出氯气在生产、生活中的应用(两条)______将氯气通入紫色石蕊试液中可观察到的现象是______.
参考答案:①该反应中,MnO2 →MnCl2,Mn元素由+4价→+2价,得2个电子,所以MnO2是氧化剂;
HCl(浓)→Cl2,Cl元素由-1价→0价,失电子,所以 HCl是还原剂;HCl→MnCl2,Cl元素的化合价没变化,所以HCl作酸参加反应,所以氧化剂与还原剂的物质的量之比是1:2;
②氧化物、单质、弱电解质写化学式,可溶性的强电解质写离子;
③氯气和水反应生成次氯酸,次氯酸有强氧化性,能消毒;氯气与碱反应生成次氯酸钙,次氯酸钙是漂白粉的有效成分;
④氯气和水反应的方程式为:Cl2+H2O=H++Cl-+HClO,H+能使紫色石蕊变成红色,
HClO? 能使有色物质褪色,所以看到的现象是:色石蕊试液先变红后退色.
故答案为:1:2;4H++2Cl-+MnO2?△?.?Mn2++Cl2↑+2H2O;自来水消毒,制漂白粉等;紫色石蕊试液先变红后褪色.
本题解析:
本题难度:一般
3、选择题 下列反应既属于氧化还原反应又属于分解反应的是( )
A.Zn+H2SO4=ZnSO4+H2↑
B.2KClO3
2KCl+3O2↑
C.S+O2SO2
D.CaCO3CaO+CO2↑
参考答案:A、Zn+H2SO4=ZnSO4+H2↑属于置换反应,也属于氧化还原反应,故A不选;
B、2KClO3MnO2.△2KCl+3O2↑属于分解反应,也属于氧化还原反应,故B选;
C、S+O2?点燃?.?SO2属于化合反应,也属于氧化还原反应,故C不选;
D、CaCO3?高温?.?CaO+CO2↑属于分解反应,但没有元素的化合价变化,则不是氧化还原反应,故D不选;
故选B.
本题解析:
本题难度:简单
4、简答题 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下
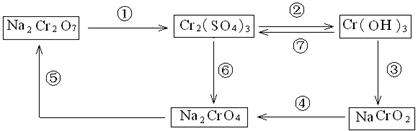
回答下列问题:
(1)上述转化关系中属于氧化还原反应的是______(填编号).
(2)反应⑤是可逆反应,向黄色的Na2CrO4溶液中加入稀硫酸,溶液逐渐变成橙色,写出该反应的离子方程式______.
(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:______.
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是______.
(5)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,其原理是以碳作阴极,铁作阳极,电解含NaCl、Cr2O72-的酸性废水.
写出电极反应和溶液中进行的反应的离子方程式:
阳极______;阴极______;溶液中______.
参考答案:(1)结合图中的转化关系,有元素化合价变化的反应是①④⑥,均属于氧化还原反应,故答案为:①④⑥;
(2)根据图中的转化关系⑤,可知铬酸根在酸性环境下可以变成重铬酸根,黄色溶液逐渐变成橙色,实质是:2CrO42-+2H+
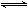
?Cr2O72-+H2O,故答案为:2CrO42-+2H+
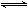
?Cr2O72-+H2O;
(3)根据图示转化关系③⑦,可以知道Cr(OH)3既能和强酸反应又能和强碱反应,和强碱反应的实质是:Cr(OH)3+OH-=CrO2-+2H2O,故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(4)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,
设Na2CrO4和NaCl的浓度都为1mol/L,Ag2CrO4沉淀时需要的c(Ag+)=
本题解析:
本题难度:一般
5、填空题 将下列四种物质:NO、Cu(NO3)2、Cu2O、HNO3的化学式分别填在空白处,并组成一个配平了的化学方程式:(已知氧化性:HNO3>Cu(NO3)2)______+______→______+______+H2O
(1)该反应中的还原剂是______.
(2)该反应中,发生还原反应的元素是______.
参考答案:NO中N元素化合价为+2,HNO3中N元素化合价为+5,Cu(NO3)2中Cu元素化合价为+2,Cu2O中Cu元素化合价为+1,且
氧化性:HNO3>Cu(NO3)2,所以硝酸作氧化剂得电子生成NO,则Cu2O失电子化合价升高作还原剂,生成Cu(NO3)2,
所以该反应方程式为:3Cu2O+14HNO3═6Cu(NO3)2+2NO↑+7H2O,
故答案为:3Cu2O、14HNO3、6Cu(NO3)2、2NO↑;
(1)该反应中氧化亚铜失电子化合价升高,所以氧化亚铜作还原剂,故答案为:Cu2O; ?
(2)该反应的硝酸中N元素得电子化合价降低,所以N元素发生还原反应,故答案为:N.
本题解析:
本题难度:一般