1、选择题 下列各组物质由于浓度不同而能发生不同氧化还原反应的是(?)
①Cu与HNO3溶液;②NaOH与AlCl3溶液;③Zn与H2SO4溶液;④Na与O2反应
A.①③
B.①②③
C.②③④
D.①④
参考答案:A
本题解析:①3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O? Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,符合题意
②两者发生的反应为非氧化还原反应,不符合题意
③Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O? Zn+H2SO4(浓)=ZnSO4+H2↑
④两者在常温或点燃的情况下,发生不同的氧化还原反应,并非浓度不同,不符合题意
答案为A
本题难度:简单
2、实验题 (16分)(1)(6分)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
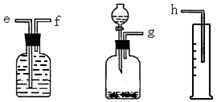
①用接口字母标出各仪器连接的顺序?量筒在实验中的作用是?
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是?。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原? B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+?D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH?
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别?
D.用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 ? b.Fe ? c.H2O2 ? d.HNO3
⑤配平下列方程式:
参考答案:(1)①? g- f-e-h ;测量气体的体积②? 23.0% (2)①? D?②? B
③ NO2- + Cl2 + H2O ="=" NO3- +2H+ +2Cl- ?④ C?⑤? 2、16、3、2、6、6、8
本题解析:(1)①钠溶于水生成氢气,因此可通过测量氢气的体积来计算钠的物质的量,所以正确的顺序是g- f-e-h。因此量筒的作用是测量气体的体积。
②在量筒中收集到0.224L水,则生成氢气是0.01mol,因此钠的物质的量是0.02mol,质量是0.46g,所以钠的质量分数是0.46÷2.0=0.23,即质量分数是23%。
(2)服用维生素C可解毒,这说明维生素C能把铁离子还原生成亚铁离子,所以维生素C具有还原性,选项ABC都是正确的,选项D不正确,答案选D。
(3)亚硝酸钠溶于水水解显碱性,而氯化钠溶于水显中性,选项A正确;甲基橙的变色范围是3.1~4.4,所以两种溶液都显黄色,选项B不正确;亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,选项C正确;亚硝酸银不能溶于水,但能溶液硝酸中,而氯化银不能溶液硝酸中,所以选项D正确,答案选B。
(4)观察到氯水褪色,说明氯水beu还原,所以方程式是NO2- + Cl2 + H2O ="=" NO3- +2H+ +2Cl-。
(5)ad都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确额的答案选C。
(6)根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从0价降低到-1价,得到1个电子,所以根据电子的得失守恒和质量守恒定律可知,配平后的化学计量数依次是2、16、3、2、6、6、8。
本题难度:一般
3、填空题 水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
选项
| 污染物
| 处理措施
| 方法类别
|
A
| 废酸
| 加生石灰中和
| 物理法
|
B
| Cu2+等重金属离子
| 加硫酸盐沉降
| 化学法
|
C
| 含纯碱的废水
| 加石灰水反应
| 化学法
|
?
(2)下图是某市污水处理的工艺流程示意图:
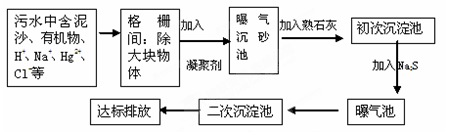
① 下列物质中不可以作为混凝剂(沉降剂)使用的是?(填字母编号,可多选)。
A.偏铝酸钠? B.氧化铝? C.碱式氯化铝? D.氯化铁
② 混凝剂除去悬浮物质的过程是?(填字母编号)。
A.只是物理过程? B. 只是化学过程? C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O?再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯?g。
参考答案:(1)C?(2)①B?②C?(3)2,4,3,2,1,6,2? 35.5
本题解析:(1)污染治理要求能除掉有毒的物质,新生成的物质对环境无污染,物理法与化学法的区别是否有新物质生成。A、酸和碱的中和反应为化学反应,为化学法,故A错误; B、硫酸铜可溶,所以不能沉淀除去,故B错误;D.碱性的废水与二氧化碳反应生成的碳酸盐和水,无污染,故D正确;
(2)①氧化铝在水中不能水解,不能生成胶状物或絮状沉淀,不能用作混凝剂,而偏铝酸钠、碱式氯化铝、氯化铁在溶液中易水解生成胶体可作为混凝剂;②混凝剂能使固体颗粒沉淀,且混凝剂在水中发生水解是化学变化,故混凝剂除去悬浮物质的过程是物?理和化学过程。
(3)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O;废水中KCN的质量为650mg/L×20L=13000mg=13g,物质的量为13g /(65g/mol )=0.2mol,使KCN完全转化为无毒物质,应生成CO、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,电子转移守恒可知2×n(Cl2)=0.2mol×(4-2)+0.2mol×[0-(-3)],解得n(Cl2)=0.5mol,故需要氯气的质量为0.5mol×71g/mol=35.5g。
本题难度:一般
4、选择题 宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是 4Ag+2H2S+O2→2X+2H2O,下列说法正确的是
A.X的化学式为AgS
B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂
D.每生成1mo1X,反应转移2mo1电子
参考答案:D
本题解析:A根据质量守恒定律可确定X的化学式是Ag2S。错误。B.银针验毒时,空气中氧气分子得到电子,化合价从反应前的0价变为反应后的H2O-2价。化合价降低。错误。C.在反应中Ag的化合价从单质Ag的0价变为反应后Ag2S中的+1价,失去电子,作还原剂; H2S中的H|S两元素的化合价都没有发生变化,故既不是氧化剂也不是还原剂。错误。D.在反应方程式中,产生 2molAg2S,转移电子4mol。所以生成1mo1Ag2S,反应转移2mo1电子。正确。
本题难度:一般
5、选择题 下列反应中,不属于氧化还原反应的是(?)
A.Fe + CuSO4= FeSO4 + Cu
B.Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
C.2H2O 2H2↑+ O2↑
2H2↑+ O2↑
D.H2 + Cl2 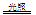 2HCl
2HCl
参考答案:B
本题解析:略
本题难度:简单