1、选择题 有甲、乙、丙、丁四种金属。将甲、乙用导线相连放入稀H2SO4中可以看到乙慢慢地溶解,而甲的表面有气体逸出。把丁放到乙的硝酸盐溶液中后,丁的表面覆盖一层乙的单质。用石墨电极电解含相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出。将甲放入稀盐酸中有H2析出。已知四种金属中有一种是铜。 根据以上实验判断铜是
[? ]
A.甲
B.乙
C.丙
D.丁
参考答案:C
本题解析:
本题难度:一般
2、简答题 实验活动课上,学生从废旧干电池中回收碳棒、锌皮、二氧化锰、氯化铵、氯化锌等主要物质.
(1)二氧化锰的作用是与正极上的产物(H2)反应,生成Mn2O3,写出该反应的化学方程式:______.
(2)得到氯化铵和氯化锌的晶体混合物后,检验其中含有NH4+的方法是______;
(3)学生将洗净的碳棒和锌皮堆放在一起晾干,一段时间后,发现锌皮上出现锈斑,用电极反应式阐明原因:______.
参考答案:(1)二氧化锰与H2反应,生成Mn2O3,根据电子注意守恒,氢气被氧化生成水,反应方程式为:2MnO2+H2=Mn2O3+H2O,
故答案为:2MnO2+H2=Mn2O3+H2O;
(2)检验其中含有NH4+的方法是;取少量晶体溶于NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则说明晶体中含有NH4+,
故答案为:取少量晶体溶于NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则说明晶体中含有NH4+;
(3)碳棒和锌皮与水膜构成原电池,锌为负极,反应氧化反应:Zn→Zn2++2e-,碳棒为正极,氧气放电生成氢氧根,电极反应式为:O2+2H2O+4e-→4OH-,Zn发生吸氧腐蚀,
故答案为:负极:Zn→Zn2++2e-,正极:O2+2H2O+4e-→4OH-.
本题解析:
本题难度:简单
3、填空题 (22分)如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
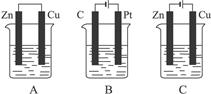
(1)A、B、C三个装置中属于原电池的是_____________。
(2)A池中Zn是_____________极, Cu极发生_____________反应,电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
(3)B池中C棒发生_________反应,电极反应为_________。B 池中的总反应为_ __。
(4)C池中Zn极的反应现象为 _____________。Cu极电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
参考答案:(1)A(2)负 还原反应 Cu2++ 2e-="Cu" 变小(3)Cu2++ 2e-=Cu CuCl2 Cu+ Cl2↑ (4)有红色物质生成 Cu
Cu+ Cl2↑ (4)有红色物质生成 Cu
本题解析:
本题难度:一般
4、选择题 按规定在食盐中添加一定量的碘化钾(KIO3)即成为可以为人体补充碘元素的“加碘食盐”.KIO3可用在一定温度下电解KI水溶液的方法制得.以下关于这一生产得叙述正确的是( )
A.KIO3在阳极产生,阴极产物为H2
B.可以用不锈钢棒作两个电极的材料
C.产生IO3-离子的电极周围溶液pH增大
D.溶液中阳离子向阳极移动
参考答案:A、电解KI水溶液时,阳极反应为:I--6e-+6OH-=I03-+3H2O,阴极反应为:2H+-2e-=H2↑,故A正确;
B、电解时应用惰性电极做电极材料,否则在阳极上放电的不是I-离子,导致电解得不到所需物质,故B错误;
C、根据阳极反应:I--6e-+6OH-=I03-+3H2O,可知阳极反应消耗OH-离子,阳极区的PH减小,故C错误;
D、电解池工作时,阴离子向阳极移动,阳离子向阴极移动,故D错误.
故选A.
本题解析:
本题难度:一般
5、计算题 用惰性电极电解NaCl和CuSO4的混合溶液250 mL,经过一段时间后,两极均生成11.2 L(标准状况)气体,求原溶液中Cu2+和Cl-的物质的量浓度范围。
参考答案:0<c(Cu2+)<2 mol·L-1,
0<c(Cl-)<4 mol·L-1
本题解析:根据题意,在阴极放电的离子有Cu2+、H+,在阳极放电的离子有Cl-、OH-(若只有Cl-放电,阴、阳两极生成的气体不可能一样多),设c(Cl-)=x,c(Cu2+)=y。
阴极反应
Cu2+? +? 2e- Cu
Cu
0.25y? 0.5y
2H++2e- H2
H2
1 mol? 0.5 mol
阳极反应
2Cl-? -? 2e-? ?Cl2
?Cl2
0.25x?0.25x? 0.125x
4OH--4e- 2H2O+O2
2H2O+O2
2 mol-0.5x? 0.5 mol-0.125x
因为阳极生成的气体不可能全为O2,
所以0<0.5-0.125x<0.5,0<x<4。
又根据阴阳两极通过电子数相等得:0.5y+1=0.25x+2-0.5x,即x=4-2y,又0<x<4,所以0<y<2。
本题难度:简单