| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《电解池原理》高频考点预测(2019年最新版)(八)
参考答案:D 本题解析:A. 根据题意要从海水中提取高浓度的锂盐,就要使海水中的Li+不断通过离子交换膜进入到左边的池中。根据同种电荷相互排斥,异种电荷相互吸引的原则,右边的电极b上应该负电荷较多,与电源的负极连接,则左边的a电极就要电源的正极连接,正确;在盐酸中含有的阳离子有H+, H+不断放电:2H++2e-=H2↑,为了维持平衡,Li+ 不断从海水进入到盐酸中,正确;C. 在过程中在a电极不断有Cl-放电产生Cl2,在b电极上,不断有H+放电产生H2,所以除了产生高浓度的锂盐,还可能获得有经济价值的副产物氢气和氯气,正确;D. 一段时间后,b电极附近溶液由于H+不断放电,c(H+)降低,所以附近溶液的pH升高,错误。 本题难度:一般 3、选择题 在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是(?) 参考答案:D 本题解析:用铂电极电解CuSO4溶液的化学方程式为2CuSO4+ 2H2O 本题难度:一般 4、选择题 如图a、b、C.d均为石墨电极,通电进行电解. |
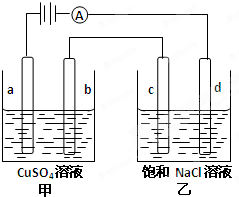
参考答案:由图可知,甲中a与电源正极相连,则a为阳极,b为阴极;乙中c为阳极,d为阴极;电极是惰性电极,溶液中的离子放电,依据离子放电顺序写出电极反应进行分析判断,
甲中发生2CuSO4+2H2O ?通电?.?2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O ?通电?.?2NaOH+H2↑+Cl2↑;
甲池中阳极a电极反应:4OH--4e_=2H2O+O2↑;阴极b电极反应为:2Cu2++4e-=2Cu;
乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑;阴极d电极反应为:4H++4e-=2H2↑;
A、甲中a的电极反应为:4OH--4e-=O2↑+2H2O,故A正确;
B、乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑;阴极d电极反应为:4H++4e-=2H2↑;电解时向乙中滴入酚酞试剂,d电极附近变红,故B错误;
C、乙中发生2NaCl+2H2O ?通电?.?2NaOH+H2↑+Cl2↑;向乙中通人适量HCl气体溶液组成可以恢复,故C正确;
D、依据电极反应和电子守恒计算,b电极反应为,2Cu2++4e-=2Cu;c电极反应为:4Cl--4e-=2Cl2↑;当b极有64gCu物质的量为1mol析出时,电子守恒得到,2Cu~2Cl2↑;C电极产生71g气体,故D错误;
故选AC.
本题解析:
本题难度:一般
5、填空题 (14分)(1)氯化铝水溶液呈 性,其离子方程式表示为 ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;
此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下图方框中画出能够实验这一反应的装置图(作必要的标注);
某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
参考答案:(1)酸(1分) Al3+ +3H2O Al(OH)3+3H+(2分) Al2O3 (1分)
Al(OH)3+3H+(2分) Al2O3 (1分)
(2)吸氧(1分) 2H2O+O2+4e-=4OH-(2分) 11.2L(1分)
(3)如图 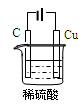 1分
1分
两极与电源的正负极接反了(或铜棒接电源的负极等)(1分)
本题解析:(1)氯化铝溶液中铝离子水解使溶液显酸性。离子方程式为: Al3+ +3H2O Al(OH)3+3H+。氯化铝水解生成氢氧化铝和氯化氢,氯化氢有挥发性,溶液中水解得到氢氧化铝,蒸干灼烧氢氧化铝分解生成氧化铝。(2)弱酸性或中性条件下,钢铁发生吸氧腐蚀,铁做负极,碳做正极,电极反应为:2H2O+O2+4e-=4OH-。根据电极反应,此反应每转移2摩尔电子消耗0.5摩尔氧气,则体积为11.2L。(3)因为铜和硫酸通常条件下不反应,所以设计成电解池,铜连接电源的正极,做电解池的阳极,阴极用石墨,溶液用硫酸。 如果看到碳上有气泡,说明碳做电解池的阳极,铜做电解池的阴极,说明两极与电源的正负极接反了。(或铜棒接电源的负极等)(1分)
Al(OH)3+3H+。氯化铝水解生成氢氧化铝和氯化氢,氯化氢有挥发性,溶液中水解得到氢氧化铝,蒸干灼烧氢氧化铝分解生成氧化铝。(2)弱酸性或中性条件下,钢铁发生吸氧腐蚀,铁做负极,碳做正极,电极反应为:2H2O+O2+4e-=4OH-。根据电极反应,此反应每转移2摩尔电子消耗0.5摩尔氧气,则体积为11.2L。(3)因为铜和硫酸通常条件下不反应,所以设计成电解池,铜连接电源的正极,做电解池的阳极,阴极用石墨,溶液用硫酸。 如果看到碳上有气泡,说明碳做电解池的阳极,铜做电解池的阴极,说明两极与电源的正负极接反了。(或铜棒接电源的负极等)(1分)
考点:盐类的水解及应用,电化学腐蚀,电解池原理。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《卤代烃》考.. | |