1、选择题 若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
[? ]
A.b=a-n-m
B.离子半径Am+<Bn-
C.原子半径A<B
D.A的原子序数比B大(m+n)
参考答案:C
本题解析:
本题难度:一般
2、选择题 以下有关原子结构及元素周期律的叙述正确的是
[? ]
A. 第IA族元素铯的两种同位素137Cs比133Cs多4个质子
B.?多电子原子中,在离核较近的区域内运动的电子能量较高
C.?若M+和R2-的核外电子层结构相同,则原子序数:R>M?
D.?P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列各表中的数字是原子序数,表中数字所表示的元素与它们所在元素周期表中的位置相符的是
[? ]
A.
B.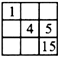
C.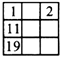
D.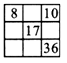
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列说法错误的是
A.原子半径:F<Mg<K
B.稳定性:PH3>H2S>NH3
C.酸性:H3PO4<H2SO4<HClO4
D.碱性:Al(OH)3<Mg(OH)2<KOH
参考答案:B
本题解析:非金属性越强,相应氢化物的稳定性越强,B中非金属性是N>S>P,所以选项B不正确,其余都是正确的,答案选B。
本题难度:困难
5、简答题 下表标出的是元素周期表的一部分元素,回答下列问题:
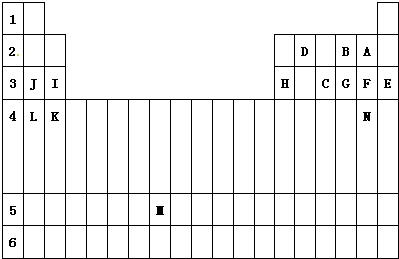
(1)表中用字母标出的14种元素中,化学性质最不活泼的是______(用元素符号表示,下同),非金属性最强的是______,常温下单质为液态的非金属元素是______.J、C、F中,原子半径最小的元素是______;属于过渡元素的是______(该空用字母表示),第六周期的元素共有______种.
(2)F,C气态氢化物中其中以______(填化学式)最不稳定;第三周期对应的碱性最强的最高价氧化物的水化物的化学式是______,该物质含有的化学键类型是______,用该物质做焰色反应实验,火焰呈______色.
(3)N元素在周期表中的位置是______,写出由F单质制取N单质的离子方程式是______.
参考答案:根据元素在周期表中的分布,可以确定D是C,B是O,A是F,J是Na,I是Mg,H是Al,C是P,G是S,F是Cl,E是Ar,L是K,K是Ca,N是Br.
(1)在元素周期表中,稀有气体元素Ar的化学性质最稳定,从左到右元素的非金属性逐渐增强,从下到上,元素的非金属性逐渐增强,所以非金属性最强的是F,液溴是常温下单质为液态非金属元素,同一周期从左到右原子半径逐渐减小,所以Cl的半径是最小的,元素周期表中第4列到第13列均是过渡元素,所以M属于过渡元素,每一周期元素的数目是2n2,
答案为:Ar;F;Br;Cl;M;32;
(2)同周期元素的原子,从左到右氢化物的稳定性逐渐增强,所以稳定性是:HCl>PH3,同周期元素的原子,从左到右最高价氧化物的水化物的碱性逐渐减弱,所以第三周期碱性最强的是氢氧化钠,氢氧化钠中含有钠离子和氢氧根之间的离子键以及氢氧根中氧和氢之间的共价键,属于离子化合物,含有钠元素的物质做焰色反应实验显黄色,
故答案为:PH3;NaOH;离子键和共价键;黄;
(3)元素N为位于周期表中第4周期ⅦA族,氯气可以将溴离子氧化为溴单质,即Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2.
本题解析:
本题难度:一般