1、选择题 下列物质中同时含有氯分子(Cl2)和氯离子(Cl-)的是
A.液氯
B.新制氯水
C.CaCl2溶液
D.次氯酸
参考答案:B
本题解析:分析:同时含有氯分子(Cl2)和氯离子(Cl-),应为混合物,且混合物中含有氯气和含氯离子,以此来解答.
解答:A.液氯为单质,只含有氯分子,故A不选;
B.新制氯水中存在Cl2+H2O?HCl+HClO,氯气的溶解度不大,则含氯气、氯离子,故B选;
C.CaCl2溶液只含氯离子,不会氯分子,故C不选;
D.次氯酸为纯净物,不含氯分子和氯离子,故D不选;
故选B.
点评:本题考查氯水的成分,明确含氯分子的物质中一定含有氯气,明确物质中的成分及物质的电离即可解答,注意HClO为分子,题目难度不大.
本题难度:简单
2、选择题 1mol下述固体物质长期放置于空气中(不考虑潮解情况),最后质量增加的大小关系是
①氧化钠?②过氧化钠?③氢氧化钠?④亚硫酸钠.
A.①=③>②>④
B.①>②>④>③
C.③>①=②>④
D.④>③>②>①
参考答案:B
本题解析:分析:①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;
②过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;
③氢氧化钠与二氧化碳反应生成碳酸钠;
④亚硫酸钠和氧气反应生成硫酸钠.
解答:①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;Na2O~Na2CO3;1molNa2O反应最后增加1molCO2的质量为 44g;
②过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;Na2O2~Na2CO3,1molNa2O2反应最后增加1molCO的质量为28g;
③氢氧化钠与二氧化碳反应生成碳酸钠;NaOH~ Na2CO3,1molNaOH反应最后增重53-40=13g;
Na2CO3,1molNaOH反应最后增重53-40=13g;
④亚硫酸钠和氧气反应生成硫酸钠;Na2SO3~Na2SO4,1molNa2SO3反应后增重16g;
故增重为①>②>④>③;
故选B.
点评:本题考查钠及其化合物性质的应用,明确变化过程中的质量变化计算是解答本题的关键,题目难度中等.
本题难度:简单
3、选择题 下列说法不正确的是
A.Na2CO3比NaHCO3溶解度大
B.Na2CO3比NaHCO3稳定
C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,得到的CO2物质的量之比为2∶1
参考答案:D
本题解析:等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成CO2的物质的量比为1∶1.
本题难度:一般
4、选择题 金属钠长期露置在空气中,最后转变为
A.Na2CO3
B.Na2O2
C.NaOH
D.Na2O
参考答案:A
本题解析:试题分析:金属钠长期露置在空气中首先与氧气反应生成氧化钠,氧化钠和水发生反应生成氢氧化钠。氢氧化钠吸收水分得到氢氧化钠溶液,然后在吸收二氧化碳得到碳酸钠溶液,溶液的水分蒸发得到碳酸钠晶体。晶体风化最后得到碳酸钠粉末。
考点:考查金属钠的保存及变质的原因、产物的知识。
本题难度:一般
5、选择题 下列物质转化在给定条件下能实现的是
①FeS2 SO3
SO3 H2SO4
H2SO4
②Al2O3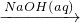 NaAlO2(aq)
NaAlO2(aq) Al(OH)3
Al(OH)3
③NaCl(aq)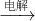 Na
Na ?Na2O2
?Na2O2
④Fe FeSO4(aq)
FeSO4(aq)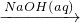 Fe(OH)2
Fe(OH)2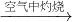 Fe2O3
Fe2O3
⑤海水 母液
母液 粗溴
粗溴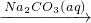
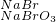
 Br2.
Br2.
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤
参考答案:C
本题解析:分析:①FeS2生成SO2;
②NaAlO2与弱酸反应生成Al(OH)3;
③应电解熔融的NaCl;
④Fe(OH)2可被氧化为Fe(OH)3;
⑤NaBr与NaBrO3在酸性条件下发生氧化还原反应生成Br2.
解答:①FeS2生成SO2,应在催化剂条件下继续与氧气反应可生成SO3,故①错误;
②Al(OH)3具有两性,与强酸反应,NaAlO2与弱酸反应生成Al(OH)3,故②正确;
③电解氯化钠溶液生成氢氧化钠、氢气和氯气,应电解熔融的NaCl,故③错误;
④Fe(OH)2可被氧化为Fe(OH)3,加热分解可生成Fe2O3,故④正确;
⑤NaBr与NaBrO3在酸性条件下发生氧化还原反应生成Br2,故⑤正确.
故选C.
点评:本题较为综合,涉及元素化合物知识的考查,侧重于基础知识,注意把握相关物质的性质,学习中注意积累,题目难度不大.
本题难度:一般