1、选择题 关于Na2CO3和NaHCO3性质的有关叙述正确的是
A.在水中溶解性:Na2CO3B.热稳定性:Na2CO3C.与酸反应的速度:Na2CO3D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3
参考答案:C
本题解析:试题分析:碳酸钠的溶解度大于碳酸氢钠的,A不正确;碳酸钠的热稳定性大于碳酸氢钠的,B不正确;碳酸钠能和CO2的水溶液反应生成碳酸氢钠,D不正确,所以正确的答案选C。
考点:考查碳酸钠和碳酸氢钠的性质比较
点评:该题是常识性知识的考查,难度不大。主要是考查学生对碳酸氢钠和碳酸钠性质的了解掌握情况,以及灵活运用基础知识解决实际问题的能力,有利于巩固学生的基础性知识。该题学生记住即可,难度不大,不难得分。
本题难度:一般
2、选择题 将5.6克Fe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加KOH溶液立即产生沉淀,滴加至沉淀量最大时,再将所得溶液和沉淀一起加热蒸干,并在空气中灼烧至恒重,所得固体成分和可能的质量为
A.Fe2O3:8gKNO2:12.7g
B.Fe2O3:8gKNO2:20.4g
C.Fe2O3:8gKNO2:31.5g
D.FeO:7.2gKNO3:16.4g
参考答案:B
本题解析:分析:根据5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,5.6gFe的物质的量为0.1mol,加入氢氧化钾后蒸干,滴加至沉淀量最大时,溶液为硝酸钾溶液,得到0.1mol铁的氢氧化物(氢氧化亚铁会被空气氧化)和0.2mol硝酸钾或硝酸钾0.3mol,蒸干并在空气中灼烧至恒重,最后得到0.05mol氧化铁和0.2mol硝酸钾或0.3mol亚硝酸钾,可分别计算出亚硝酸钾的质量范围.
解答:5.6gFe的物质的量为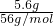 =0.1mol,
=0.1mol,
若铁全部恰好生成硝酸亚铁,根据铁元素守恒n[Fe(NO3)2]=n(Fe)=0.1mol,
加入氢氧化钾后,加热蒸干,并在空气中灼烧至恒重,固体为氧化铁与硝酸钾.
根据硝酸根子守恒可得n(KNO3)=2n[Fe(NO3)2]=2×0.1mol=0.2mol,
根据铁元素守恒可得n(Fe2O3)= n(Fe)=
n(Fe)= ×0.1mol=0.05mol,
×0.1mol=0.05mol,
所以固体质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钾0.2mol×69g/mol=13.8g
若铁全部恰好生成硝酸铁,根据铁元素守恒n[Fe(NO3)3]=n(Fe)=0.1mol,
根据硝酸根子守恒可得n(KNO3)=3n[Fe(NO3)2]=3×0.1mol=0.3mol,
加入氢氧化钾后,加热蒸干,并在空气中灼烧至恒重,固体为氧化铁与硝酸钾.
根据铁元素守恒可得n(Fe2O3)= n(Fe)=
n(Fe)= ×0.1mol=0.05mol,
×0.1mol=0.05mol,
所以固体质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钾0.3mol×69g/mol=20.7g
所以氧化铁质量是8g,亚硝酸钾质量在13.8g~20.7g之间.
故选:B.
点评:本题考查混合物的计算,题目难度较大,注意本题考虑5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,利用端值法求解.
本题难度:困难
3、选择题 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,原因是它们均含有
A.氯气
B.次氯酸
C.次氯酸根
D.氯化氢
参考答案:B
本题解析:
本题难度:一般
4、选择题 SO2和Cl2都有漂白作用,用SO2和Cl2的混合气体漂白有色的湿布条,则其漂白的能力
A.与SO2相同
B.与Cl2相通
C.减弱或消失
D.增强
参考答案:C
本题解析:此题解答很容易只顾各自的漂白能力,而忽视SO2和Cl2在有水存在的情况下能够发生氧化还原反应;即SO2+Cl2+2H2O=H2SO4+2HCl。反应的发生,使其漂白能力就减弱或消失了。
本题难度:简单
5、选择题 下列反应中硫酸只表现强氧化性是
A.烧碱与硫酸反应
B.碳酸钠与硫酸反应
C.木炭粉与浓硫酸反应
D.铜与浓硫酸反应
参考答案:C
本题解析:烧碱与硫酸反应体现硫酸的酸性,碳酸钠与硫酸反应也是体现硫酸的酸性。木炭粉与浓硫酸反应只体现浓硫酸的强氧化性,铜与浓硫酸反应既体现酸性也体现氧化性。
本题难度:一般