|
高考化学知识点总结《离子方程式的书写及正误判断》高频试题强化练习(2019年最新版)(十)
2020-08-13 07:11:09
【 大 中 小】
|
1、填空题 写出下列各反应的离子方程式:
(1)氧化铁与稀盐酸: ;
(2)硫酸铜溶液中加入氢氧化钡溶液: ;
(3)少量Ca(HCO3)2滴入足量烧碱溶液中:
。
参考答案:(1)氧化铁与稀盐酸: Fe2O3 +6H+ = 2Fe3+ +3H2O ;(2分)
(2)硫酸铜溶液中加入氢氧化钡溶液:(2分)
Cu2++SO42-+Ba2+ + 2OH- =BaSO4↓+Cu(OH)2↓ ;
( 3)少量Ca(HCO3)2滴入足量烧碱溶液中:(2分) 3)少量Ca(HCO3)2滴入足量烧碱溶液中:(2分)
Ca2++2HCO3-+2OH-=CaCO3 ↓+CO32- +2H2O
本题解析:略
本题难度:一般
2、选择题 下列离子方程式中,错误的是( )
A.氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.将氨通入盐酸溶液中:NH3+H+= NH4+
C.在漂白粉溶液中通入SO2:Ca2++2ClO-+ SO2+H2O = CaSO3↓+2HClO
D.将少量铜屑放入浓硝酸中:Cu+4H++2NO3- = Cu2++2NO2↑+ 2H2O
|
参考答案:C
本题解析:A.反应符合事实,拆写无误,正确; B.将氨通入盐酸溶液中:NH3+H+= NH4+反应符合事实,拆写无误,正确;C.在漂白粉溶液中通入SO2由于产生的HClO有强氧化性,会把CaSO3氧化为CaSO4,离子方程式是:Ca2++ClO-+ SO2+H2O = CaSO4↓+Cl-。错误;D.反应符合事实,拆写符合离子方程式的原子,正确。
考点:考查离子方程式书写的正误判断的知识。
本题难度:一般
3、实验题 高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:
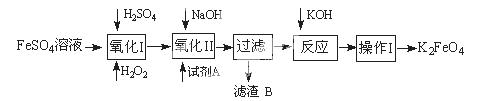
查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定
②溶解度很大,难溶于无水乙醇等有机溶剂
③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液
回答下列问题:
(1)写出“氧化I”中,生成Fe3+的离子反应方程式 。
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaClO”);过滤操作中,得到的滤渣B中除NaCl还有
(3)操作I中包括冷却结晶、过滤、洗涤干燥几个步骤。洗涤干燥的目的是脱碱脱水,进行该操作时最好用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4 + H2O = Fe(OH)3↓ + KOH +
(5)将一定量的K2FeO4投入一定浓度的FeCl3溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是 。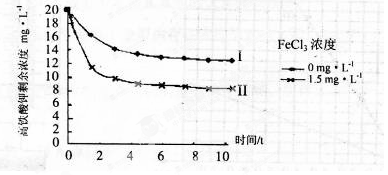
参考答案:(16分)
(1)H2O2+2H++2Fe2+=2Fe3++2H2O(3分,配平错扣1分)
(2)NaClO Na2SO4(各2分,共4分)
(3)无水乙醇(3分)
(4)4 10 4 8 3O2 ↑ (产物正确1分,共3分)
(5)FeCl3溶液水解显酸性,促进K2FeO4与水反应,从而降低K2FeO4浓度(3分)
本题解析:(1)原料为硫酸亚铁溶液,所含亚铁离子具有还原性,硫酸是强酸,提供氢离子,不仅能抑制亚铁离子和铁离子的水解,而且能增强过氧化氢的氧化能力,使亚铁离子氧化为铁离子,根据化合价升降法、电荷守恒、原子守恒配平,则氧化I中生成铁离子的离子方程式为H2O2+2H++2Fe2+=2Fe3++2H2O;(2)由于目标产物是K2FeO4,它在碱性环境中稳定,在中性和酸性条件下不稳定,则氧化II中加入的氧化剂不能使H2O2,因为H2O2在碱性条件下的氧化性比酸性条件下弱,试剂A也不能是HNO3,因为酸性条件下Na2FeO4不稳定,试剂A只能是 NaClO,氧化II中反应为2NaOH+H2SO4=Na2SO4+2H2O、Fe2(SO4)3+3NaClO+10NaOH==2Na2FeO4+3NaCl+3Na2SO4+5H2O;根据已知信息可知,K2FeO4的溶解度很大,由此类推Na2FeO4的溶解度很大,为了从Na2FeO4、NaCl、Na2SO4、NaClO(过量)、NaOH(过量)组成的混合溶液中分离出Na2FeO4、NaOH(过量),则过滤所得滤渣的主要成分为NaCl、Na2SO4、NaClO(过量),除去它们之后所得的Na2FeO4、NaOH(过量)溶液用于制备K2FeO4;(3)Na2FeO4、NaOH(过量)溶液中加入过量KOH时的反应为:Na2FeO4+2KOH= K2FeO4+2NaOH,所得溶液经过蒸发浓缩、冷却结晶、过滤、洗涤可得K2FeO4晶体;由于K2FeO4的溶解度很大,难溶于无水乙醇等有机溶剂,且具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液,除去碱的同时,为了减少洗涤晶体造成K2FeO4的损失,最好选择无水乙醇洗涤K2FeO4晶体;(4)观察可得,该反应中铁元素由+6价将为+3价,钾元素、氢元素的化合价都没有变化,根据氧化还原反应的特征推断,化合价升高的元素只能是氧,氧元素由—2价升为其相邻的0价,则缺项物质为氧气,根据化合价升降法、原子守恒配平可得:4K2FeO4+10H2O==4Fe(OH)3↓ +8KOH+3O2↑;(5)根据已知信息可知,K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定,氯化铁是强酸弱碱盐,能水解,导致其溶液显弱酸性,K2FeO4在酸性条件下不稳定,酸性越强,K2FeO4越不稳定,反应速率越大,剩余K2FeO4的浓度越小。
考点:考查物质制备化学工艺流程,涉及离子方程式的书写和配平、滤渣成分的推断、氧化还原反应方程式的书写和配平、晶体的洗涤方法和试剂、提取信息并用于解释原因等。
本题难度:困难
4、填空题 (10分)元素周期表中第三周期元素的单质及其化合物的用途广泛。
(1)该周期元素中,半径最小的简单离子的离子结构示意图为 。
(2)能证明氯的非金属性(得电子能力)比硫强的化学方程式为 。
(3)NaHSO3溶液呈酸性,其溶液中离子浓度由大到小的顺序为 。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为 。
(5)已知下列两反应过程中能量变化如图所示:
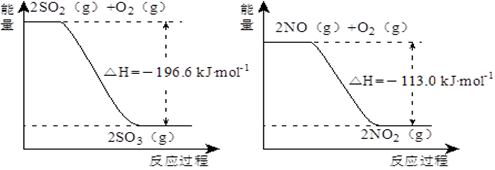
汽车尾气中含有的少量NO2和SO2在一定条件下会发生反应,该反应的热化学方程式为____________。
参考答案:(1)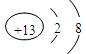 (2分)(2)Cl2 + H2S = S↓ + 2HCl 或Cl2 + Na2S = S↓+ 2 NaCl(2分) (2分)(2)Cl2 + H2S = S↓ + 2HCl 或Cl2 + Na2S = S↓+ 2 NaCl(2分)
(3)[Na+]>[HSO3-]>[H+]>[ SO32-]>[OH-](2分)
(4)2 ClO2 + 5Mn2+ + 6H2O = 5MnO2 ↓+ 2Cl- + 12H+(2分)
(5)NO2(g) + SO2(g) =" NO(g)" + SO3(g) △ H = -41.8kJ·mol-1 (2分)
本题解析:(1)在第三周期元素中,半径最小的简单离子是铝离子,其离子结构示意图为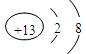 。 。
(2)非金属性强元素单质能置换出非金属性弱的单质,则能证明氯的非金属性(得电子能力)比硫强的化学方程式为Cl2 + H2S = S↓ + 2HCl。
(3)NaHSO3溶液中电离程度大于水解程度,因此溶液呈酸性,所以其溶液中离子浓度由大到小的顺序为[Na+]>[HSO3-]>[H+]>[ SO32-]>[OH-]。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,则根据电子得失守恒以及质量守恒定律可知该反应的离子方程式为2 ClO2 + 5Mn2+ + 6H2O = 5MnO2 ↓+ 2Cl- + 12H+。
(5)根据图像可知反应的热化学方程式为① O2(g) +2SO2(g) =2SO3(g) △ H =-196.6kJ·mol-1、②2NO(g) + O2(g) =2NO2(g) △ H = -113.kJ·mol-1,则根据盖斯定律可知(①-②)÷2即得到NO2(g) + SO2(g) =" NO(g)" + SO3(g) △ H = -41.8kJ·mol-1。
考点:考查元素周期律的应用以及热化学方程式书写等
本题难度:一般
5、选择题 下列离子方程式正确的是
A.NaHSO3溶液中投入过氧化钠粉末:4HSO3- +2Na2O2 ="=" 4SO32- + O2 ↑ + 4Na+
B.明矾溶液与等物质的量的氢氧化钡溶液混合:
3Ba2+ +6OH— + 2Al3+ + 3SO42—
|