1、填空题 某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验

序号
| A
| B
| 烧杯中的液体
| 指针是否偏转
|
1
| Zn
| Cu
| 稀硫酸
| 有
|
2
| Zn
| Zn
| 稀硫酸
| 无
|
3
| Cu
| C
| 氯化钠溶液
| 有
|
4
| Mg
| Al
| 氢氧化钠溶液
| 有
|
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)
参考答案:(1)电子 ; (2)铝 ;Al-3e-+4OH- = AlO2-+2H2O ; (3)② ; (4)①
本题解析:(1)实验1中Zn比铜活泼,铜与稀硫酸不反应,所以锌应为原电池的负极,Cu为正极,电流从正极流向负极,即从B极流向A极,所以由A极流向B极的是电子。
(2)实验4中电子由B极流向A极,表明负极是铝。这是由于Al可与NaOH溶液反应而Mg不反应,所以形成原电池时Al为负极,Mg为正极,负极反应式为Al-3e-+4OH- = AlO2-+2H2O。
(3)实验3中指针发生偏转,说明构成了原电池。铜是金属,碳棒是能导电的非金属,这说明铜在潮湿的空气中易发生电化学腐蚀,为自发的氧化还原反应,故答案选②。
(4)①相对活泼的金属不一定做负极,如实验4中电子由B极流向A极,Al为负极,故①错误;②负极发生氧化反应,因此失去电子的电极是负极,故②正确;③烧杯中的液体,必须是电解质溶液,原电池工作时溶液中通过离子的定向移动形成闭合回路,故③正确;④形成原电池的两极应是活泼性不同的两种金属或金属与非金属,可形成电势差而形成电流,故④正确,答案选①。
考点:考查原电池工作原理探究的实验设计与评价
本题难度:一般
2、选择题 下列反应不可以用于设计成原电池的是
[? ]
A.KOH+HCl=KCl+H2O △H<0
B.2CH3OH+3O2→2CO2+4H2O △H<0
C.Zn+H2SO4=ZnSO4+H2△H<0
D.4Al+3O2+6H2O=4Al(OH)3 △H<0
参考答案:A
本题解析:
本题难度:简单
3、简答题 铁和铁的化合物用途广泛.请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:______.
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______.
(2)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2
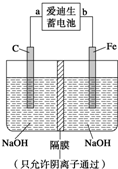
①爱迪生蓄电池的正极是______,该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______.
②高铁酸钠(Na2FeO4)是一种新型净水剂.用如图装置可以制取少量高铁酸钠.写出在用电解法制取高铁酸钠时,阳极的电极反应式______.
③你认为高铁酸钠作为一种新型净水剂的理由错误的是______.
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为______.
参考答案:(1)钢铁在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子O2+4e-+2H2O=4OH-,负极上铁失电子发生氧化反应,正极上发生的反应为O2+4e-+2H2O=4OH-,二价铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,氢氧化铁失去部分水生成铁锈,所以铁锈的成分是Fe2O3?xH2O,氧化铁和稀硫酸反应生成硫酸铁和水,离子方程式为:Fe2O3+6H+═2Fe3++3H2O,铁和铁离子能发生氧化还原反应生成亚铁离子2Fe3++Fe=3Fe2+,导致溶液中不存在铁离子,
故答案为:O2+4e-+2H2O=4OH-;Fe2O3+6H+═2Fe3++3H2O、2Fe3++Fe=3Fe2+;
(2)①放电时,镍元素的化合价由+4价变为+2价,所以NiO2作正极,充电时,铁电极上氢氧化亚铁得电子发生还原反应生成铁,
故答案为:NiO2;还原反应;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
③高铁酸钠具有强氧化性,所以能杀菌消毒;高铁酸钠能被还原生成铁离子,铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附悬浮杂质,所以能净水,故选ad;
(3)设Fe2+与Fe3+物质的量分别为x、y,根据铁原子、氧原子守恒得(x+y):(x+1.5y)=4:5,x=y,所以x:y=1:1,故答案为:1:1.
本题解析:
本题难度:一般
4、选择题 可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是?
A.以NaCl溶液或NaOH溶液为电解液时,正极反应式都为:O2+2H2O+4e-===4OH-
B.以NaOH溶液为电解液时,负极反应式为Al+3OH--3e-===Al(OH)3
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
参考答案:C
本题解析:A、电解质溶液显碱性或中性,该燃料电极的正极发生反应为:O2?+2H2O+4e-=4OH-,故A正确; B、铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e-=AlO2-+2H2O,故B错误;C、该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-=4AlO2-+2H2O,溶液pH降低,故C错误;D、电池工作时,电子从负极出来经过外电路流到正极,故D错误。
本题难度:一般
5、选择题 下列关于原电池的叙述中正确的是
A.正极和负极必须是两种不同的金属
B.原电池是把化学能转化成电能的装置
C.原电池工作时,负极上发生是还原反应
D.锌、铜和盐酸构成的原电池工作时,电子从铜片经导线流向锌片
参考答案:B
本题解析:
本题难度:一般