1、选择题 下列溶液有时呈黄色,其中是由于久置时被空气中氧化而变色的是?
A.浓硝酸
B.硫酸亚铁
C.工业盐酸
D.稀溴水
参考答案:B
本题解析:题目中给出的选项均可呈黄色。但原因各异。浓HNO3是因其中含有HNO3分解产物的NO2,工业盐酸是因为合Fe3+,而溴水则是其本色。FeSO4的溶液应为浅绿色。但Fe2+易被空气中O2氧化成Fe3+,Fe3+的水溶液呈黄色。
本题难度:一般
2、填空题 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备 CuSO4·5H2O及纳米材料G,步骤如下:

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为_____(填代号)。
a.KMnO4? b.(NH4)2S? c.H2O2? d.KSCN
向溶液B中加入CuO的作用是?。
(2)由溶液C获得CuSO4·5H2O,需要经过? ?、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)写出制备G的化学反应方程式。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。

(4)欲测定溶液A中Fe2+的溶液,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用?。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为?。
参考答案:(1)cd?(2分 ) 调节溶液的pH值,促进Fe3+水解?(2分)
(2)加热蒸发、冷却结晶(2分 )?引流?(2分)
(3)2NH3+CO2+CaCl2+H2O=CaCO3↓+2NH4Cl?(2分 )? b?(2分)
(4)酸式滴定管?(2分 ) 溶液变成紫红色并保持半分钟不褪色?(2分)
本题解析:(1)本实验要除去Fe2+、Fe3+等离子,先加入合适的氧化剂时不能引入新的杂质,可加入H2O2,发生的反应为:2H2O2+2Fe2++2H+═2Fe3++4H2O,因Fe3+遇KSCN溶液变为血红色,则可用KSCN检验Fe3+;故答案为:c;d;向溶液B中加入CuO的作用是调节溶液的pH值,促进Fe3+水解。(2)从溶液中要析出晶体,采用冷却结晶法,然后进行过滤等操作,过滤用到的仪器有烧杯、玻璃棒、漏斗、滤纸等仪器,其中玻璃棒在过滤时起到引流的作用,在蒸发时起到搅拌的作用,故答案为:冷却结晶;玻璃棒;搅拌、引流;(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3,实验室收集氨气时要注意防止倒吸,因为氨气极易溶于水,吸收时导管不能插入到液面以下,可用倒置的漏斗,故答案为:2NH3+CO2+CaCl2+H2O=CaCO3↓+2NH4Cl?;b;(4)高锰酸钾具有强氧化性,则只能用酸式滴定管盛装高锰酸钾溶液,终点现象为溶液变成紫红色并保持半分钟不褪色 。
本题难度:一般
3、实验题 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成:
①铁不同价态的物质各写一种(并标出铁元素的化合价):_____、_______、 ________。
②写出一个它们之间相互转化(含三种价态)的化学方程式:___________________ 。
(2)实验室提供的下列试剂:锌粒、铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性。
根据氧化还原反应的有关原理,小明说Fe2+既有还原性又有氧化性,为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
探究内容
| 实验方案
| 实验现象
|
探究Fe2+具有还原性
| 取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________
| 溶液变成血红色
|
探究Fe2+具有氧化性
| 取少量0.1 mol·L-1 FeCl2溶
液,加入_________充分
反应
| 溶液由浅绿色变无色
所发生反应离子方程式为________________
|
?
参考答案:(1)①

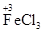 (其他合理的答案也可)②Fe+2FeCl3=3FeCl2
(其他合理的答案也可)②Fe+2FeCl3=3FeCl2
(2)
实验方案
实验现象
取少量0.1 mol·L-1 FeCl2溶液,加入足量新制氯水后,再往溶液中加入少量KSCN溶液
加入氯水后,溶液由浅绿色变黄色,再加入少量KSCN溶液后溶液变红色
取少量0.1 mol·L-1 FeCl2溶液,加入锌粒充分反应
加入锌粒后,溶液由浅绿色变无色Fe2++Zn=Fe+Zn2+
本题解析:(1)铁常见的化合价就只有三种:零价、正二价、正三价;金属铁还原三价铁离子成二价铁离子就是一个三种化合价的铁都有的铁的反应方程式;
(2)还原性的检验是用氯水来氧化二价铁离子,氧化性的检验是用多属单质来还原三价铁离子。
本题难度:一般
4、填空题 某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全):

(1)生成气体B的化学方程式是_____________________________ 。
(2)将固体D投入过量稀硫酸并充分反应后,过滤,再向滤液加入双氧水,得黄色溶液。 写出当加入双氧水时溶液中发生反应的离子方程式:________________________ 。
(3)若已知固体X的质量为7.2g反应中Al粉的质量是2.7g,气体B在标准状况下的体积为672mL,则固体D的质量是____________ g.
参考答案:(1)2Al+2NaOH+2H2O==2NaAlO+3H2↑
(2)2Fe2++H2O2+2H+==2Fe2++2H2O
(3)5.28
本题解析:
本题难度:困难
5、选择题 钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I.打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体,其化学式为?;铁粉与水蒸气在高温下也可生成该黑色固体,反应的化学方程式为?。
II.某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
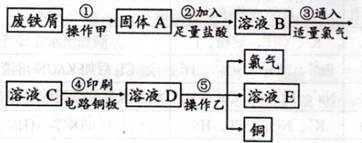
请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为?。
(2)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是(?)
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①②
B.②⑨
C.⑨④
D.①④