1、填空题 某短周期元素原子最外层电子数为次外层的2倍,其单质甲可发生:
甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。
①甲与乙反应的化学方程式为 ?。
② NO2可作火箭重要燃料—肼(N2H4)的助燃剂。N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1,2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=—1135.7 kJ·mol-1,写出肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:?。
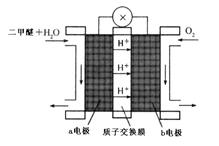
③二甲醚(CH3OCH3)也被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等,“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。b电极是?极,写出a电极上发生的电极反应式?。

(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是?。
②完成SO2使KMnO4褪色的离子方程式:
?MnO4- +?SO2 +?=?Mn2+ +?SO42- +?H+
③一定条件下:2SO2(g)+O2(g) 2SO3(g) △H<0。反应的平衡常数表达式K=?;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是?
2SO3(g) △H<0。反应的平衡常数表达式K=?;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是?
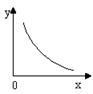
a.x表示温度,y表示n(SO2) ?b.x表示压强,y表示SO2的转化率
c.x表示n(SO2),y表示n(O2) ?d.x表示n(SO3),y表示化学平衡常数K
参考答案:C+4HNO3(浓)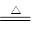 CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
N2H4(g)+O2(g)=N2(g)+2H2O(g)?△H=-534kJ/mol;正?CH3OCH3+3H2O-12e-=2CO2+12H+
(2)①蓝色晶体变白色粉末?②2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+?③ (2分); c(2分)
(2分); c(2分)
本题解析:某短周期元素原子最外层电子数为次外层的2倍,则该元素是碳元素。
(1)①若丙为NO2,则乙是浓硝酸,因此甲与乙反应的化学方程式是C+4HNO3(浓)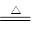 CO2+4NO2↑+2H2O。
CO2+4NO2↑+2H2O。
②根据盖斯定律可知,(①+②)÷2即得到N2H4(g)+O2(g)=N2(g)+2H2O(g),所以该反应的反应热△H=(+67.7kJ/mol-1135.7 kJ/mol)÷2=—534kJ/mol。
③b电极通入的是氧气,实验题b极是正极。A极通入二甲醚,作负极,电极反应式是CH3OCH3+3H2O-12e-=2CO2+12H+。
(2)①若丙为SO2,则乙是浓硫酸。浓硫酸具有吸水性,所以把乙滴入硫酸铜晶体,观察到的现象是蓝色晶体变白色粉末。
②锰元素的化合价降低5个单位,S元素的化合价所给2个单位,所以根据电子得失守恒可知,SO2使KMnO4褪色的离子方程式2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。
③化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式可知,平衡常数K= 。正方应是体积减小的放热的可逆反应,则升高温度,平衡向逆反应方向移动,SO2的物质的量增加,A不正确;增大压强,平衡向正反应方向移动,SO2的转化率增大,B不正确;增大SO2的浓度,平衡向正反应方向移动,O2的物质的量减少,C正确;平衡常数只与温度有关系,D不正确,答案选C。
。正方应是体积减小的放热的可逆反应,则升高温度,平衡向逆反应方向移动,SO2的物质的量增加,A不正确;增大压强,平衡向正反应方向移动,SO2的转化率增大,B不正确;增大SO2的浓度,平衡向正反应方向移动,O2的物质的量减少,C正确;平衡常数只与温度有关系,D不正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,贴近高考,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
2、选择题 T℃下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)?CO2(g)+H2O(g),部分数据见下表(表中t2>t1):
| 反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol
0
1.20
0.60
0
0
t1
0.80
t2
0.20
|
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=mol?L-1?min-1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60?mol,n(H20)=1.20?mol,则平衡时n(C02)=0.20?mol
参考答案:A、由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,v(CO)=0.4mol2Lt1min=0.2t1mol/(L?min),速率之比等于化学计量数之比计算v(H2)=v(CO)=0.2t1mol/(L?min),故A错误;
B、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,故CO的转化率为0.4mol1.2mol×100%=33.3%,故B错误;
C、t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol-0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算7平衡常数,则k=0.4×0.40.8×0.2=1,故C正确
D、CO与H2O按物质的量比1:1反应,充入0.60?mol?CO和1.20?mol?H2O与充入1.20?mol?CO和0.6mol?H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 合成氨工业有下列流程:①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。其先后顺序为(?)
A.①②③④
B.①③②④
C.④③②①
D.②③④①
参考答案:B
本题解析:对于合成氨工业工艺流程,首先制取原料气,然后在进入合成塔之前,为防止催化剂中毒及动力因素,要对原料气进行净化和压缩。进入合成塔进行合成后,要及时分离出液氨,并进行循环操作,以增强N2和H2的利用率。
本题难度:一般
4、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,有关说法正确的是?(?)
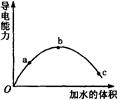
A a、b、c三点溶液的pH:a>b>c
B 若用湿润的pH试纸测量c处溶液的pH,比实际pH偏小
C a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D a、b、c三点溶液醋酸的电离度:c>b>a
参考答案:D
本题解析:稀释有利于醋酸的电离,即C点对应的电离程度最大,D正确。溶液中离子的浓度越大,导电性越强,即b点的酸性最强,但pH最小,即a、b、c三点溶液的pH:c>a>b。PH试纸若事先润湿,则在测量醋酸的PH时相当于稀释了醋酸,所以测量值偏大。醋酸稀释时溶质的物质的量并没有变化,所以中和氢氧化钠的量也不会变化。答案是D。
本题难度:一般
5、填空题 在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表 :
:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)(mol)
| 0.020
| 0.011
| 0.008
| 0.007
| 0.007
| 0.007
|
(1)写出该反应的平衡常数表达式:K=?。
(2)如图中表示NO2的变化的曲线是?。用O2表示从0~2s内该反应的平均速率v=?

(3)能说明该反应已达到平衡状态的是?。
a.v(NO2)=2v(O2)? b.容器内压强保持不变
c.v逆 (NO)=2v正(O2)? d.容器内密度保持不变
(4)某同学查阅资料得知,该反应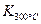 >
> ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为?。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为?。
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是?。
a.及时分离除NO2气体? b.适当升高温度
c.增大O2的浓度? d.选择高效催化剂
参考答案:(12分)(1)K=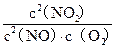 ?(2)b? 1.5×10-3mol·L-1·s-1?(3)b c?
?(2)b? 1.5×10-3mol·L-1·s-1?(3)b c?
(4) 2NO(g)+O2(g) ?2NO2(g)? ΔH=" -112.8" kJ ?(5)c
?2NO2(g)? ΔH=" -112.8" kJ ?(5)c
本题解析:略
本题难度:简单