1、选择题 在标准状况下,将V?L?A气体(摩尔质量是M?g/mol)溶于0.1L水中,所得溶液的密度为d?g/cm3,则此溶液的物质的量浓度为( )
A.
B.
C.
D.
参考答案:标准状况下,气体的物质的量为VL?22.4L/mol?=V22.4 mol,气体的质量为V22.4 mol×M g?mol-1=VM?22.4g,
水的质量为100mL×1g/mL=100g,即溶液的质量为VM22.4g+100g,则溶液的体积为VM?22.4g+100g?d?g?cm-3×10-3L,
则该溶液的物质的量浓度为V?22.4molVM22.4g+100g?d?g?cm-3?×10-3L?=1000VdMV+2240?mol?L-1,故选:B.
本题解析:
本题难度:简单
2、填空题 将28 g KOH固体溶于172 g水中形成溶液A。
(1)溶液A的质量分数为? ?;
(2)若将该溶液蒸发掉100 g水后形成溶液B,体积为80 mL。则溶液B的物质的量浓度为
? ?mol·L—1。
参考答案:(1)14%(6分) (2)6.25(7分)
本题解析:略
本题难度:简单
3、选择题 现在CO和CO2 两种气体,它们所含氧原子的物质的量均为1 mol ,则 CO 与CO2的分子数之比为
A.1 :1
B.1 :2
C.2 :1
D.3 :2
参考答案:C
本题解析:CO和CO2两种气体,它们所含氧原子的物质的量均为1 mol ,则n(CO)=1mol,n(CO2)=1/2mol。分子数之比等于物质的量之比,故比例为2 :1。选择C选项。
本题难度:一般
4、计算题 已知一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为_______
(2)所得溶液中Cl-的物质的量为________mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=______________。
参考答案:(6分)
(1)10.7%?(2分)(2)0.25 (2分) (3)3:2 (2分)
本题解析:由题意知,n(NaOH)="3.00" mol·L-1×100×10-3?L="0.300" mol
(1)NaOH溶液的质量分数为: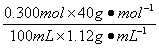 ×100%=10.7%
×100%=10.7%
(2)所得溶液中含有NaCl和NaClO,根据Na+守恒可得:n(Na+)=n(Cl-)+n(ClO-),所以
n(Cl-)=n(Na+)-n(ClO-)="0.300" mol-0.050 0 mol="0.250" mol
(3)NaClO物质的量为0.0500mol,则Cl2?+ 2NaOH =" NaCl" +? NaClO + H2O ?
0.0500mol 0.100mol ?0.0500mol?
所以与HCl反应的NaOH为:0.300mol-0.100mol=0.200mol?
HCl +? NaOH? =? NaCl + H2O
0.200mol?0.200mol ?
H2与Cl2反应生成HCl ?H2? +? Cl2? ?2HCl
?2HCl
0.100 mol? 0.100 mol? 0.200 mol
所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)="(0.100" mol+0.050 0 mol):0.100 mol=3:2
本题难度:一般
5、选择题 类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.由2Cu + O2 2CuO可推出同族的硫也有Cu + S
2CuO可推出同族的硫也有Cu + S CuS
CuS
B.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C.Na能与水反应生成H2,K、Ca也能与水反应生成H2
D.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
参考答案:C
本题解析:S的氧化性较O2弱,Cu 与S反应生成Cu2S,A错。Fe3O4中有2个三价铁,1个二价铁,而Pb3O4中是1个四价铅,2个二价铅,故Pb3O4可表示为2PbO·PbO2,B错。K、Ca、Na都是活泼金属,与水能反应,C对。Na2O2具有强氧化性,SO2与Na2O2反应生成Na2SO4,故D错,选C
本题难度:一般