| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《难溶电解质的溶解平衡》考点特训(2020年冲刺版)(八)
参考答案:B 本题解析:A、加入适量新制氯水,再加几滴KSCN溶液,溶液变红,若原溶液中存在铁离子,也会使溶液变红色,不一定含有亚铁离子,错误;B、取少量卤代烃Y在碱性溶液中水解后再用硝酸酸化,中和氢氧化钠后,再滴加AgNO3溶液,生成白色沉淀,则该白色沉淀一定是氯化银沉淀,说明卤代烃中含有氯原子,正确;C、醛基与氢氧化铜浊液的反应应是碱性溶液,该实验中硫酸铜过量,导致溶液呈酸性,所以不产生砖红色沉淀,不能说明Y中不含有醛基,错误;D、向浓度均为0.1 mol·L—1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明氢氧化铜更难溶,则Ksp[Cu(OH)2]<Ksp[Mg(OH)2],错误,答案选B。 本题难度:一般 5、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12,某溶液中含有C1-, Br- 和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 |
参考答案:C
本题解析:生成AgCl沉淀所需Ag+的浓度为:c(Ag+)=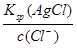 =
=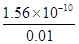 = 1.56×10-8 mol·L-1
= 1.56×10-8 mol·L-1
生成AgBr沉淀所需Ag+的浓度为:c(Ag+)=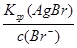 =
=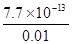 = 7.7×10-11 mol·L-1
= 7.7×10-11 mol·L-1
生成Ag2CrO4沉淀所需Ag+的浓度为:c(Ag+)=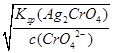 =
= =3.0×10-5 mol·L-1
=3.0×10-5 mol·L-1
根据计算可知,三种离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,故C正确。
考点:了解难溶电解质的沉淀溶解平衡。了解溶度积的含义及其表达式,能进行相关的计算。
点评:在一定温度下,在难溶化合物的饱和溶液中组成沉淀的各离子的浓度的乘积是一常数,称溶度积常数。运用Ksp的公式进行计算,只要注意到AgCl、AgBr和Ag2CrO4的Ksp表达式不同,计算银离子的浓度即可。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《分子式、结.. | |