1、推断题 现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种强酸的酸式盐,将C加入BaCl2溶液有不溶于盐酸的 ?白色沉淀生成,D晶体在于燥空气中容易失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如图所示(无关物质已略去),请回答:?
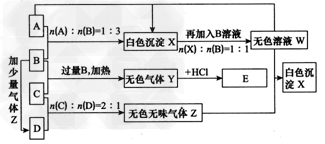
(1)将A溶液蒸干并灼烧得到的固体是___(写化学式)。 ?
(2)Y的电子式是____,Z的结构式是____。 ?
(3)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序为____。 ?
(4)有人设想在适当大小的管道中填充一定量的D的晶体(相对分子质量在280~300之间),管道环绕在一个房子的周围, ?这样的房子白天和晚上室内温度可保持相对恒定,请简述其原理:____ 。?
(5)写出过量的Z与W反应生成X的化学方程式:____。 ?
(6)写出C与过量B反应(加热)的离子方程式:____。
参考答案:(1)?Al2O3?
(2)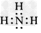 ?;O=C=O
?;O=C=O
(3)c(Na+)>c(SO42- )>c(NH4+)>c(H+)=c(OH-)
(4)白天有太阳,Na2CO3·10H2O分解吸热,晚上H2O和Na2CO3再结合成晶体放热,可以调节温度
(5)CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3
(6)?NH4++H++2OH- NH3↑+2H2O
NH3↑+2H2O
本题解析:
本题难度:一般
2、填空题 (1)有人将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
①通甲烷的铂丝为原电池的______极,发生的电极反应为______.
②该电池工作时(放电)反应的总化学方程式为______.
(2)X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式为______;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为______
③将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为______.
参考答案:(1)①燃料燃烧时失电子发生氧化反应,原电池的负极上失电子发生氧化反应,所以通甲烷的铂丝为原电池的负极;甲烷燃烧生成二氧化碳和水,二氧化碳是酸性氧化物能和氢氧化钾反应生成碳酸钾和水,所以该电极上的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
故答案为:负;CH4+10OH--8e-=CO32-+7H2O;?
②甲烷失电子发生氧化反应,氧气得电子发生还原反应,氧气得电子和水反应生成氢氧根离子,所以该反应的电池反应式为:CH4+2O2+2OH-=CO32-+3H2O;
故答案为:CH4+2O2+2OH-=CO32-+3H2O;
(2)①Y是短周期非金属元素的单质且常温下为固体,和Z反应生成气体,所以Y只能是S;硫和非金属单质反应且生成的物质是气体,所以非金属单质为氢气、氧气,A在空气中充分燃烧可生成B,所以A硫和氢气反应的产物,B是硫和氧气反应的产物,从而确定X是氢气,Z是氧气,A是硫化氢,B是二氧化硫.
故答案为:SO2;
?②H2S是二元弱酸,能和氢氧化钠反应生成硫化钠和水,当硫化氢过量时硫化钠和硫化氢反应生成硫氢化钠.
故答案为:H2S+OH-=HS-+H2O;
③氯气有强氧化性,二氧化硫既有氧化性又有还原 性,当遇到强氧化剂时,二氧化硫作还原剂被氧化,所以二氧化硫和氯气的水溶液反应生成盐酸和硫酸.
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
本题解析:
本题难度:一般
3、推断题 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白
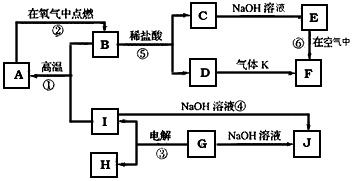
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置_________________,
(2)写出检验D溶液中阳离子的方法___________________。
(3)写出反应④的离子方程式_______________________。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式:___________________________;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH________7 (填“>”、“<”或“=”),用离子方程式表示其原因:___________________;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是_______________________。
参考答案:(1)第四周期、第Ⅷ族
(2)取少许D溶液于试管中,滴加KSCN溶液,溶液变红色,证明D溶液中含有Fe3+(答案合理即可)
(3)2Al+2OH-+2H2O==2AlO2-+3H2↑?
(4)3Fe(s)+2O2(g)==Fe3O4(s) △H=-6QkJ/mol?
(5)<;NH4++H2O NH3·H2O+H+;c(NH4+>c(SO42-)>c(H+)>c(OH-)
NH3·H2O+H+;c(NH4+>c(SO42-)>c(H+)>c(OH-)
本题解析:
本题难度:困难
4、填空题 有A、B、C、D、E、F、G、H等常见物质,已知有如下图转化关系,其中B、C?为常见非金属单质;F为常见金属单质;B在C中燃烧时,火焰呈苍白色;A和D的焰色反应为黄色.G和D溶液混和,产生红褐色沉淀.
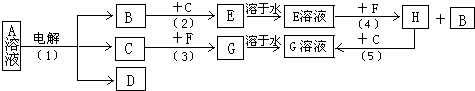
(1)反应(1)中若生成0.1mol?B,则转移的电子的物质的量为______.写出C与F反应的化学方程式______.(注明反应条件)
(2)图中所示的5个反应中属于氧化还原反应的有:______.(填写编号)
参考答案:(1)B在C中燃烧时,火焰呈苍白色,说明B是H2,C是Cl2,则E是HCl气体,E溶液为盐酸.A和D的焰色反应为黄色,说明A和D中含Na+.G和D溶液混和,产生红褐色沉淀,为Fe(OH)3沉淀,说明G中含Fe3+,结合F为常见金属单质,推得F为金属Fe.反应(3)为Cl2和Fe反应生成FeCl3,反应(4)为盐酸和Fe反应生成FeCl2和H2,反应(5)为FeCl2和Cl2反应生成FeCl3.B是H2,C是Cl2,D中含Na+,根据电解原理推得反应(1)是电解饱和食盐水,即A溶液为NaCl溶液.反应(1)方程式为:2NaCl+2H2O═2NaOH+H2↑+Cl2↑,生成1molH2转移2mol电子,则生成0.1molH2,转移的电子的物质的量为0.2mol,C与F反应的化学方程式为:2Fe+3Cl2?点燃?.?2FeCl3,
故答案为:0.2mol;2Fe+3Cl2?点燃?.?2FeCl3;
(2)反应(1)方程式为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,
反应(2)方程式为:H2+Cl2?点燃?.?2HCl,
反应(3)方程式为:2Fe+3Cl2?点燃?.?2FeCl3,
反应(4)方程式为:2HCl+Fe═FeCl2+H2↑,
反应(5)方程式为:2FeCl2+Cl2═2FeCl3.
上述5个反应中都有化合价的变化,所以都属于氧化还原反应.
故答案为:(1)、(2)、(3)、(4)、(5).
本题解析:
本题难度:一般
5、选择题 下列各组物质中,不能按

(“→”表示一步完成)关系相互转化的是( )
A.a物质:Fe; b物质:FeCl3;c物质:FeCl2
B.a物质:Cl2; b物质:NaClO;c物质:NaCl
C.a物质:Al; b物质:Al(OH)3;c物质:NaAlO2
D.a物质:Cu; b物质:CuSO4;c物质:CuCl2
参考答案:C
本题解析:
本题难度:一般