| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《热化学方程式》试题预测(2020年最新版)(九)
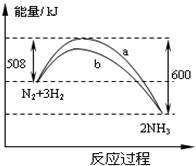 2、填空题 (9分)(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
②已知:N2(g) + 3H2(g)  2NH3(g) ΔH= -92.4kJ·mol—1 2NH3(g) ΔH= -92.4kJ·mol—12H2(g) + O2(g)  2H2O(l) ΔH = -571.6kJ·mol—1 2H2O(l) ΔH = -571.6kJ·mol—1则常温下氮气与水反应生成氨气与氧气的热化学方程式为: (2)①已知:0.5mol液态肼(N2H4)与足量的液态双氧水反应生成氮气和水蒸气,放出256kJ的热量,写出该反应的热化学方程式 ②又已知H2O(g)=H2O(l) △H=-44kJ?mol-1。则32g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是 kJ ③此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是 3、填空题 反应热是指反应过程中放出或吸收的热量。由于在化学反应过程中发生物质变化时,同时伴有能量变化,根据反应的情况不同,一般将反应热分为燃烧热和中和热等多种形式。 4、填空题 (14分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(2)已知:C(s)+O2(g)=CO2(g) △H=akJ·mol—1; 2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1; 2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1. 方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。 (3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。 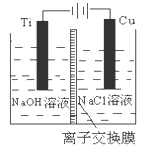 (4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。 (5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。 (6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验: 2H2O(g) 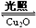 2H2(g)+O2(g) 2H2(g)+O2(g) 5、简答题 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快 c.甲醇的物质的量增加 d.重新平衡时
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:______(用化学方程式表示). (5)使用燃料电池是节能减排的重要手段之一.CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO+3H2=CH3OCH3+CO2?或?2CO+4H2=CH3OCH3+H2O.上述水煤气燃料电池的负极反应方程式:(写1个)______. (6)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.根据该图写出二甲醚燃烧的热化学方程式:______   |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《原子核外电.. | |