1、选择题 科学家根据元素周期律和原子结构理论预测,原子序数为114的元素称为类铅元素.下面关于它的原子结构和性质预测正确的是
A.类铅元素原子的最外层电子数为5
B.其常见价态为+2、+3、+4
C.它的金属性比铅强
D.它的原子半径比铅小
参考答案:C
本题解析:根据周期表的结构可知,114号元素位于第七周期,第ⅣA,常见化合价是+2和+4价。同主族自上而下原子半径逐渐增大,金属性逐渐增强,所以答案选C。
本题难度:一般
2、选择题 A、B、C、D为原子序数依次增大的同周期的短周期元素。已知A、C、D三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是
[? ]
A.A、C、D三种元素的最高价氧化物对应的水化物有两种是强碱、一种是强酸或两种是强酸、一种是强碱
B.A、C、D三种元素有两种是金属、一种是非金属
C.D元素在第三周期第ⅥA族
D.A、B、C三种元素的单质熔沸点依次降低
参考答案:B
本题解析:
本题难度:一般
3、简答题 实验题:
某化学兴趣小组做了如下三个实验:
实验A:集气瓶中放青色、未熟的水果(蔬菜),盖上玻璃片;
实验B:集气瓶中放青色、未熟的水果(蔬菜),通入一定量的乙烯;
实验C:集气瓶中放青色、未熟的水果(蔬菜),瓶底放少量KMnO4固体,盖上玻璃片.
请根据所学化学知识完成下列问题:
(1)预期实验结果:水果成熟的先后顺序是______(用序号填写)
(2)解释你的预期结果的原因______.
为探究?Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中;
2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液;
3将一小段镁带投入稀盐酸中;
4将一小片铝投入稀盐酸中.
实验现象
A剧烈反应,迅速生成大量的气体
B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红
C反应不剧烈,产生无色气体
D有气体产生,溶液变成红色
|
(1)请在下表中填写与实验步骤对应的实验现象序号:
(2)请写出钠与水反应的方程式______.
(3)请你补充该小组同学用原子结构理论对上述实验结论的解释:
同周期元素从左到右核电荷数逐渐增多,原子半径逐渐______,失电子能力逐渐______,因此______性逐渐减弱.
参考答案:I、(1)乙烯可以做水果催熟剂,而高锰酸钾固体能和乙烯反应,故答案为:BAC;
(2)乙烯可以做水果催熟剂,而高锰酸钾固体能和乙烯反应,因此B中水果最先熟,而C中水果最后熟,
故答案为:乙烯可以做水果催熟剂,而高锰酸钾固体能和乙烯反应,因此B中水果最先熟,而C中水果最后熟;
II:(1)金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,和水及酸反应置换出氢气的程度是越来越难,和水以及酸反应的现象可以根据此来回答,故答案为:实验步骤1234实验现象BDAC(2)金属钠和水反应生成氢氧化钠和氢气,即2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)同周期元素从左到右核电荷数逐渐增多,原子半径逐渐减小,失电子能力逐渐减弱,金属性逐渐减弱,故答案为:减小,减弱,金属.
本题解析:
本题难度:一般
4、填空题 在1~ 18号元素中,用元素符号回答下列问题:
(1)最外层电子数等于次外层电子数的元素___。
(2)次外层电子数是最外层电子数2倍的元素____。
(3)内层电子总数是最外层电子数2倍的元素____。
(4)与水反应最剧烈的金属是____。
(5)地壳中含量最高的金属元素是____。
(6)单质氧化性最强的元素是____。
参考答案:(1)Be、Ar?
(2) Li、Si
(3)Li、P
(4)Na
(5)Al
(6)F
本题解析:
本题难度:一般
5、简答题 下面是元素周期表的简略框架图.
回答下列问题:
(1)元素a在元素周期表中的位置是______,元素i的原子核外最外层电子数为______,元素f和h形成化合物的电子式是______.
(2)元素c和g中,非金属性较强的是______(填元素符号),支撑这一结论的化学事实是______.
(3)写出由cd2转化为cd的化学方程式:______;b、d、e形成的一种盐俗称纯碱,其中常混有其对应的酸式盐,用化学方程式表示除去该酸式盐的方法:______.
参考答案:(1)由元素在周期表中的位置可知,a为氢,i为氩,f为镁,h为氯,则氢元素在第一周期、ⅠA族,氩的质子数为
18,其最外层电子数为8,Mg与Cl形成化合物时镁失去最外层2个电子成为金属阳离子,氯原子得到1个电子成为氯离子,氯化镁的电子式为
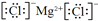
,故答案为:第一周期、ⅠA族;8;
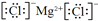
;?
(2)c为氮,g为磷,同主族元素随原子序数的增大,非金属性减弱,则N元素的非金属性强,可由HNO3的酸性比H3PO4强或NH3的热稳定性比PH3强等来说明非金属性N>P,故答案为:N;HNO3的酸性比H3PO4强或NH3的热稳定性比PH3强等;?
(3)d为氧,则cd2转化为cd,即NO2转化为NO,转化的反应为3NO2+H2O═2HNO3+NO,纯碱中常混有其对应的酸式盐为
NaHCO3,其受热容易分解生成碳酸钠,从而达到除杂的目的,其反应为2NaHCO3?△?.?Na2CO3+H2O+CO2↑,
故答案为:3NO2+H2O═2HNO3+NO;2NaHCO3?△?.?Na2CO3+H2O+CO2↑.
本题解析:
本题难度:一般