1、选择题 从原子序数11依次增加到17,下列所述递变关系中,错误的是( )
A.电子层数逐渐增多
B.原子半径逐渐减小
C.最高正化合价数值逐渐增大
D.从硅到氯,最低负化合价从-4到-1
参考答案:A.原子序数11到17的元素在周期表同一周期,电子层数相等,故A错误;
B.同周期元素从左到右原子半径逐渐减小,故B正确;
C.原子序数11到17的元素在周期表同一周期,自左到右元素的最高化合价依次增大,故C正确;
D.从硅到氯,最低负化合价依次为-4、-3、-2、-1,故D正确.
故选A.
本题解析:
本题难度:简单
2、选择题 我国最新报道的高温超导体中,铊(Tl)是成分之一.已知铊与铝是同族元素,关于铊的性质判断中,可能错误的是
A.是银白色的金属
B.能生成+3价的化合物
C.Tl(OH)3与Al(OH)3一样,是两性氢氧化物
D.与稀HNO3作用,生成硝酸盐
参考答案:C
本题解析:解析:本题考查根据元素在周期表中的位置推断其性质的能力.因铊与铝同族,性质应相似,根据同主族性质递变规律找出其中错误的,便是答案.
根据铊与铝是同族元素,可推知铊的化合价与铝相同,都是+3价,选项B正确,不是本题答案.铊的金属性比铝强,其对应的氢氧化物的碱性应比Al(OH)3强,所以Tl(OH)3不会具有两性,故选项C是错误的,是本题的答案.Tl是银白色金属,可与稀HNO3作用,生成硝酸盐,这与ⅢA族性质递变规律不矛盾,所以选项A、D不是本题答案.
思路导引:把握问题的实质,不要被“最新”“高温超导”等词语所迷惑.
本题难度:困难
3、选择题 电子层数相同的X、Y、Z三种元素,已知最高价氧化物水化物的酸性是H3XO4<H2YO4<HZO4,则下列判断正确的是
A.非金属性强弱为X>Y>Z
B.气态氢化物的稳定性强弱为X>Y>Z
C.原子序数大小为X>Y>Z
D.原子半径大小为X>Y>Z
参考答案:D
本题解析:非金属性强弱判断的依据应用.非金属性强弱、原子序数、氢化物稳定性均为X<Y<Z.
本题难度:简单
4、推断题 X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是__________________________________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1 ?b.+29.7 kJ·mol-1? c.-20.6 kJ·mol-1? d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受来源:91考试网 91ExAm.org热分解生成化合物Q.写出阳极生成R的电极反应式:____________________;由R生成Q的化学方程式为:________________________。
参考答案:(1)O;第三周期第ⅢA族;Al>C>N>O>H 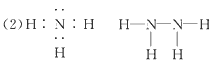
(3)34;H2SeO4;b
(4)Al+3HCO3--3e-===Al(OH)3↓+3CO2↑ (或Al-3e-===Al3+、Al3++3HCO3-===Al(OH)3↓+3CO2↑)
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
本题解析:
本题难度:一般
5、推断题 工业上用矿物M(含有X、Y、Z三种元素)在空气中高温煅烧,X、Y、Z分别转化成A、B、C三种产物,A、B、C的物质的量之比为1:1:2,其中A为单质,9.6 g A溶于稀硝酸后产生(标准状况下)2.24 L气体 G,G遇空气呈红棕色,向所得溶液中滴加NaOH溶液,生成蓝色沉淀;B中Y元素与氧元素的质量比为7:2,B溶于适量的稀硝酸得到溶液W和无色气体G,W溶液中滴入硫氰化钾溶液呈血红色;C为酸性氧化物,且常温下呈气态,将C通入氯化钡溶液中,无明显现象,再滴加双氧水产生白色沉淀。
(1)指出Z元素在周期表中的位置___________,Z与处于同一周期且原子半径最大的元素(除稀有气体)所形成的稳定化合物的电子式为_____________。
(2)写出C与双氧水、氯化钡溶液产生沉淀的离子方程式:______________________。
(3)在游泳池中通常用X的硫酸盐来消毒杀菌,试说明该盐能起消毒杀菌作用的本质原因是__________;试推断M的化学式为__________。
(4)将X的单质溶于N2O4的乙酸乙酯溶液中可制得无水硝酸盐,同时生成G,请写出以上反应的化学方程式:______________________。
参考答案:(1)第三周期第ⅥA族;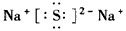
(2)H2O2+SO2+Ba2+=BaSO4↓+2H+
(3)Cu2+使蛋白质变性;CuFeS2
(4)Cu+2N2O4=Cu(NO3)2+2NO↑
本题解析:
本题难度:一般