1、选择题 不能用H++OH-=H2O表示的反应是(?)
A.盐酸与氢氧化钾溶液反应
B.稀硫酸与氢氧化钡溶液反应
C.稀硝酸与氢氧化钠溶液反应
D.硫酸与氢氧化钠溶液反应
参考答案:B
本题解析:略
本题难度:一般
2、选择题 在100mL?0.10mol/L的?AgNO3溶液中,加入100mL溶有2.08g?BaCl2的溶液,再加入100mL溶有0.010mol?CuSO4-5H2O的溶液,充分反应.下列说法中正确的是( )
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.10mol/L
参考答案:AgNO3的物质的量为0.1L×0.10mol/L=0.01mol,BaCl2的物质的量为2.08g208g/mol=0.01mol,
CuSO4?5H2O的物质的量为0.010mol,
? Ag++Cl-═AgCl↓
0.01? 0.01? 0.01
?Ba2++SO42-═BaSO4↓
0.01?0.01?0.01
A、因铜离子没有参加反应,则最终得到白色沉淀和蓝色溶液,故A错误;
B、由计算可知,氯化银和硫酸钡白色沉淀的物质的量都是0.01mol,故B正确;
C、反应前Cl-的物质的量为0.02mol,参加反应的物质的量为0.01mol,则反应后Cl-的物质的量为0.01mol,故C错误;
D、在最终得到的溶液中,Cu2+的物质的量浓度为0.010mol0.3L=0.033mol/L,故D错误;
故选B.
本题解析:
本题难度:简单
3、填空题 (1)用离子方程式表达下列应用或现象
①向澄清石灰水中通二氧化碳气体变浑浊?
②铝片和Hg(NO3)2溶液的反应?
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①CuO +2H+=Cu2++H2o??
②CO32-+ 2H+=CO2↑+ H2O??
参考答案:(1) ①? CO2 + Ca2+ + 2OH-? ="===?" CaCO3↓+ H2O?
②? 2Al+3Hg2+ ="====?" 2Al3+ + 3Hg?
(2) ① ?CuO+2HCl=====Cu Cl2 +? H2O?
Cl2 +? H2O?
②? Na2CO3 + 2HCl="===2NaCl+" H2O + CO2↑?。
本题解析:略
本题难度:简单
4、选择题 下列离子方程式的书写正确的是( )
A.铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+
B.NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O
C.氯气溶于水:Cl2+H2O?2H++Cl-+ClO-
D.氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O
参考答案:A.铁和稀硝酸反应的离子反应为Fe+NO3-+4H+=2H2O+Fe3++NO↑,故A错误;
B.NaHCO3溶液与NaOH溶液反应的离子反应为OH-+HCO3-=CO32-+H2O,故B正确;
C.氯气溶于水的离子反应为Cl2+H2O?H++Cl-+HClO,故C错误;
D.氯化铝溶液中加入过量的氨水的离子反应为Al3++3NH3?H2O=Al(OH)3↓+4NH4+,故D错误;
故选B.
本题解析:
本题难度:一般
5、填空题 以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题
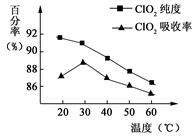
(1)据图可知,反应时需要控制的适宜温度是?℃,达到此要求采取的适宜措施是?。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式:?。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol· (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· ?K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
?K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+= +5Fe3+ +2H2O?14H+ +
+5Fe3+ +2H2O?14H+ +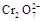 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)?
参考答案:(1)30℃,水浴加热(或水浴控制恒温);(2)15ClO3-+FeS2+14H+=15ClO2+Fe3++7H2O+2SO42-
(3)与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;
与ClO2反应的n(Fe2+)=37×10-3L×0.0500mol/L-6×10-3mol=1.25×10-2mol
n(ClO2)=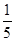 ?×1.25×10-2mol=2.5×10-3mol
?×1.25×10-2mol=2.5×10-3mol
ClO2的产率=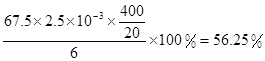
本题解析:(1)据图可知,在20℃反应时ClO2气体制取纯度高,但是气体的吸收率较低,在30℃无论是反应制取ClO2气体纯度高还是气体的吸收率都较高。若温度再升高,制取ClO2气体纯度高还是气体的吸收率都降低。所以需要控制的适宜温度是30℃。达到此要求采取的适宜措施是水浴加热(或水浴控制恒温)。(3)由方程式4H++ClO2+5Fe2+= +5Fe3+ +2H2O?14H+ +
+5Fe3+ +2H2O?14H+ +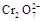 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=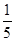 ×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=
×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=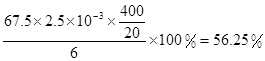 。
。
本题难度:一般