1、填空题 解决问题时,要不断加强提炼和归纳,从个别事实中找出一般的、本质的东西。离子方程式的书写中遵循“少数服从多数的思想”。判断下列离子方程式书写有无错误,有错误的指出错因并改正。
(1)碳酸钙与硝酸反应:CO32- +2H+=CO2↑+H2O
__________________________
(2)氧化铜溶于稀硫酸:O2- +2H+=H2O
__________________________
(3)碳酸氢钠溶液与盐酸混合:CO32-+2H+=CO2↑+H2O
__________________________
(4)硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42- =BaSO4↓
__________________________
(5)铜片加入稀硫酸中:Cu+2H+=Cu2++H2↑
__________________________
(6)向氢氧化钡溶液中通入少量CO2:CO2 +OH-=HCO3-
__________________________
(7)氢氧化铁溶于硝酸中:Fe(OH)3+3H+=Fe3++3H2O
__________________________
参考答案:(1)错误;碳酸钙是难溶物,应写成化学式。正确的应为:CaCO3+2H+=Ca2++CO2↑+H2O
(2)错误,氧化铜是氧化物,应写成化学式,正确的为:CuO+2H+=Cu2++H2O
(3)错误,碳酸氢钠电离时,HCO3-不拆开,正确的为:HCO3-+ H+=H2O+CO2↑
(4)错误,漏写氢氧化铜,正确的是:Ba2++2OH-+Cu2++SO42- =BaSO4↓+Cu(OH)2↓
(5)错误,铜与稀硫酸不反应。
(6)错误,少量的CO2与氢氧化钡反应生成碳酸钡,正确的应为:CO2+Ba2++2OH-=BaCO3↓+H2O
(7)正确。
本题解析:
本题难度:一般
2、简答题 根据电离理论:在水溶液中电离出的______全部是______的化合物,叫做酸.因此酸具有通性,请用离子方程式表示下列酸的通性:
(1)盐酸溶解铁锈(Fe2O3):______
(2)盐酸与小苏打(NaHCO3):______
(3)硫酸溶解氢氧化铜:______
(4)实验室用H2SO4和锌反应制取H2:______.
参考答案:酸为电离出的阳离子全部为氢离子的化合物,故答案为:阳离子,氢离子;
(1)氧化铁为金属氧化物,与酸反应生成盐和水,反应的离子方程式为6H++Fe2O3=2Fe3++3H2O,
故答案为:6H++Fe2O3=2Fe3++3H2O;
(2)盐酸与小苏打反应生成二氧化碳气体和水,反应的离子方程式为HCO3-+H+=CO2↑+H2O,
故答案为:HCO3-+H+=CO2↑+H2O;
(3)硫酸溶解氢氧化铜发生中和反应生成硫酸铜和水,反应的离子方程式为Cu(OH)2+2H+=Cu2++2H2O,
故答案为:Cu(OH)2+2H+=Cu2++2H2O;
(4)锌为活泼金属,与硫酸发生置换反应生成氢气,反应的离子方程式为Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑.
本题解析:
本题难度:一般
3、选择题 能正确表示下列反应的离子方程式为
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O
B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O
C.硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
参考答案:B
本题解析:选项A,NaHCO3溶液与Ca(OH)2溶液反应一定生成CaCO3;选项B,在溶液中ClO-能将SO2氧化为SO42-;选项C,BaS与稀硫酸反应生成更难溶的BaSO4沉淀;选项D,在强碱溶液中,不可能生成H+。
本题难度:一般
4、选择题 下列离子方程式正确的是(?)
A.澄清石灰水中滴加稀硫酸:Ca(OH)2+2H+====Ca2++2H2O
B.实验室用氨水制备少量Al(OH)3:Al3++ 3OH-====Al(OH)3↓
C.向FeBr2溶液中通入过量氯气:2Fe2++Cl2====2Fe3++2Cl-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
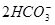 +2OH-====CaCO3↓+
+2OH-====CaCO3↓+ +2H2O
+2H2O