1、选择题 下列有关碱金属元素的性质,从上到下递变规律正确的是( )
A.金属性逐渐减弱
B.化合价逐渐升高
C.失电子能力逐渐增强
D.最高价氧化物对应的水化物碱性逐渐减弱
参考答案:因碱金属元素的具有相似性与递变性可知:
A、因同一主族,从上到下,电子层数逐渐增多,原子半径逐渐增大,金属性逐渐增强,故A错误;
B、因碱金属元素的最外层电子数为1,最高化合价都为+1,故B错误;
C、因同一主族,从上到下,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,故C正确;
D、因同一主族,从上到下,电子层数逐渐增多,原子半径逐渐增大,金属性逐渐增强,金属性越强,最高价氧化物对应的水化物碱性越强,故D错误.
故选:C.
本题解析:
本题难度:简单
2、选择题 2008年,美国和俄罗斯科学家将大量48Ca离子加速去轰击人造元素249Cf,从而制造出一种新原子。它的原子核包含118个质子和179个中子。下列有关该元素的叙述正确的是
[? ]
A.该元素的相对原子质量为297
B.这是一种金属元素
C.这是一种原子序数为118的新元素
D.这是一种主族元素
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列物质的性质比较,正确的是( )
A.气态氢化物稳定性:HF>HCl>H2S
B.碱性:NaOH>KOH>RbOH
C.非金属性:P>S>Cl
D.酸性:H2SO4>HClO4>HBrO4
参考答案:A.非金属性:F>Cl>S,元素的非金属性越强,对应的氢化物越稳定,则气态氢化物稳定性:HF>HCl>H2S,故A正确;
B.金属性:Rb>K>Na,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:NaOH<KOH<RbOH,故B错误;
C.P、S、Cl位于周期表相同周期,同周期元素从左到右元素的非金属性逐渐增强,则非金属性:P<S<Cl,故C错误;
D.已知非金属性:Cl>Br>S,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,则酸性:HClO4>HBrO4>H2SO4,故D错误.
故选A.
本题解析:
本题难度:一般
4、填空题 下表表示元素周期表的一部分,回答下列有关问题(要求用化学用语):
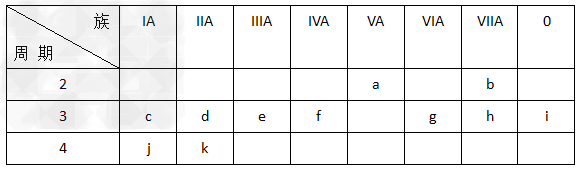
(1)写出下列元素符号:d______ 、 i______。?
(2)k原子的电子层数为_____,f原子最外层电子数为_____。?
(3)这11种元素中,单质的化学性质最稳定的是_____。?
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的是_________,碱性最强的是_________,呈两性的是_________(写化学式);写出它们两两反应的化学方程式:_______________?、 ______________ 、______________ 。
(5)证明c、d原子失电子能力强弱的实验方法是____________________________;证明g、h原子得电子能力强弱的方法(用离子方程式表示)是__________________________。
参考答案:(1)Mg;Ar
(2)4;4?
(3)Ar?
(4)HClO4;KOH ;Al(OH)3;HClO4+KOH= KClO4 + H2O;Al(OH)3 + 3HClO4 = Al(ClO4)3 + 3H2O;Al(OH)3 + KOH = K[Al(OH)4]
(5)Na与冷水反应生成氢气比Mg更剧烈;Cl2 + S2- = 2Cl- + S↓ 或Cl2 + H2S = 2H+ + 2Cl- + S↓
本题解析:
本题难度:一般
5、选择题 甲乙两种非金属:①甲比乙容易与H2化合;②甲的氢化物比乙的氢化物稳定③甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.能说明甲比乙的非金属性强的是( )
A.①②③
B.只有⑤
C.只有④
D.①②③④⑤
参考答案:①甲比乙容易与H2化合,可说明甲比乙的非金属性强,故①正确;
②甲的氢化物比乙的氢化物稳定,可说明甲比乙的非金属性强,故②正确;
③甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强,可说明可说明甲比乙的非金属性强,故③正确;
④与某金属反应时甲原子得电子数目比乙的多,不能说明可说明甲比乙的非金属性强,非金属性的强弱只与等电子的能力有关,故④错误;
⑤甲的单质熔沸点比乙的低,属于物理性质,与得失电子的能力无关,不能用来判断非金属性的强弱,故⑤错误.
正确的有①②③,
故选A.
本题解析:
本题难度:一般