1、选择题 下列事实不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.在硫化氢水溶液中加入碱有利于S2-
参考答案:B
本题解析:勒夏特列原理是指:如果改变影响平衡的条件之一(如浓度、温度、压强),平衡将会向着能够减弱这种改变的方向上移动;
A可以,啤酒中存在平衡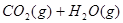 ?
?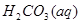 开启瓶盖后,压强减小,平衡将向逆反应方向移动;B错,反应存在平衡
开启瓶盖后,压强减小,平衡将向逆反应方向移动;B错,反应存在平衡 ?
? 加压,碘蒸气浓度增大,颜色加深;但平衡不移动;C可以,氯水中存在平衡
加压,碘蒸气浓度增大,颜色加深;但平衡不移动;C可以,氯水中存在平衡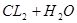 ?
?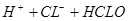 ,加碳酸钙后,会与溶液中的氢离子反应,使平衡向正反应方向移动,溶液中的HCLO溶液增大,漂白性增强;D正确,硫化氢溶液中有平衡:
,加碳酸钙后,会与溶液中的氢离子反应,使平衡向正反应方向移动,溶液中的HCLO溶液增大,漂白性增强;D正确,硫化氢溶液中有平衡: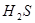 ?
?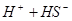 ,加碱,中和氢离子,使硫化氢的向电离方向移动生成更多的硫离子;
,加碱,中和氢离子,使硫化氢的向电离方向移动生成更多的硫离子;
本题难度:一般
2、简答题 (16分)雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图31-1所示:
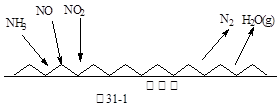 ?
?
①由图31-1可知SCR技术中的氧化剂为:?。
②图31-2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为:?、?。
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图31-3所示,脱氮效果最佳的c(NO2)/c(NO)=?。已知生成1molN2反应放出的热量为QkJ,此时对应的脱氮反应的热化学方程式为?。

(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) H2SO3(l)
H2SO3(l) H+(aq)+HSO3—(aq) ?I
H+(aq)+HSO3—(aq) ?I
HSO3—(aq) H+(aq)+SO32—(aq)?II
H+(aq)+SO32—(aq)?II
Ca(OH)2(s) Ca2+(aq)+2OH—(aq)?III
Ca2+(aq)+2OH—(aq)?III
Ca2+(aq)+SO32—(aq) CaSO3(s)?IV
CaSO3(s)?IV
④步骤II的平衡常数K的表达式为?。
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度。(写出计算过程,保留2位有效数字)
参考答案:(1)① NO、NO2?(2分)?② Mn (2分)? 200-250℃或范围内间任意温度(2分)
③1:1 (2分)? 2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol (3分)
2N2(g)+3H2O(g) ΔH=-2QkJ/mol (3分)
(2) ④K=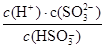 ?(2分)
?(2分)
⑤c(SO32-)=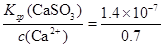 ?mol/L=2×10-7mol/L(3分)
?mol/L=2×10-7mol/L(3分)
本题解析:(1)①根据反应前后元素化合价变化可知,氨气中氮元素的化合价从-3价升高到0价,失去电子被氧化做还原剂;氮氧化合中氮元素的化合价降低,得到电子被还原做氧化剂,因此氧化剂是NO、NO2。
②根据图像可知,两种催化剂的脱氮率几乎是相同的,但Mn所在曲线的温度低,所以由图可知最佳的催化剂和相应的温度分别为Mn和200~250℃或范围内间任意温度。
③根据图像可知c(NO2)/c(NO)=1:1是脱氮率最高,由于每生成1molN2反应放出的热量为QkJ,所以此时对应的脱氮反应的热化学方程式为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
(2) ④化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据化学方程式可知,该反应的平衡常数表达式K=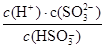 。
。
⑤根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)·c(SO32-)可知,c(SO32-)=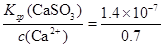 mol/L=2×10-7mol/L。
mol/L=2×10-7mol/L。
本题难度:一般
3、填空题 (满分10分)有两个容积相等的密闭容器A和B(如图)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等。在400℃条件下,发生如下反应:2SO2(g) + O2(g) 2SO3(g)。
2SO3(g)。
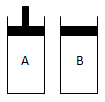
(1)达到平衡时,所需的时间t(A)?t(B),A容器中SO2的转化率比B容器中?。(填“大、小或相等)
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡?移动,B容器中化学平衡?移动。(填“向左、向右、不”)
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3)?,B容器中SO3的质量分数?。(填“增大、减少或不变”)
参考答案:(1)<(1分) , 大 (2分)(2)向左(1分),?不(2分)
(3)不变 (2分), 增大(2分)。
本题解析:(1)因为反应是体积减小的可逆反应,所以在反应过程中B中的压强始终小于A中的压强,压强小,反应速率小,到达平衡的时间就多。高压有利于平衡向正反应方向移动,所以A中的转化率高。
(2)A保持恒压,B保持恒容,因此通入少量的等量氩气,A中的体积必然增大,导致浓度降低,平衡向逆反应方向移动。B中的压强虽然增大,但浓度不变,所以平衡不移动。
(3)A保持恒压,因此再通入等量原反应气体,平衡时和原平衡是等效的,因此含量不变。B保持恒容,再通入等量原反应气体,相当于增大压强,平衡向正反应方向移动,生成物的含量增大。
本题难度:一般
4、填空题 将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g) +B(g)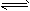 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用生成物C的浓度增加来表示该反应的速率为:_________________;
(2)用生成物A的浓度减少来表示该反应的速率为:_________________;
(3)反应前A、B的物质的量浓度分别是:_________________、_________________。
(4)10s末,生成物D的浓度为_________________。
参考答案:(1)0.04mol/(L·s)
(2)0.06mol/(L·s)
(3)1.5mol/L;0.5mol/L
(4)0.4mol/L
本题解析:
本题难度:一般
5、简答题 I、恒温下,将amolN2与bmolH2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a=______.
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量______.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=______.
(4)原混合气体中,a:b=______.
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=______.
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
II、若向体积不变的密闭容器中充入2molN2和6molH2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),平衡时混合气共7mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c=______.
(2)若a=0.7,b=2.1,则:
①c=______.
②这时反应向______进行,因为:______.
③若要维持反应开始向该反应方向进行,c的范围是______.
(3)欲使起始反应维持向与②相反的方向进行,则b的范围是______.
参考答案:(1)由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1:2,设转化的N2的物质的量为xmol,
则x:6=1:2,解之x=3,所以a=13+3=16mol,故答案为:16;
(2)由n=716.8L22.4L/mol=32mol,NH3的含量(体积分数)为25%,
n平(NH3)=32mol×25%=8mol,故答案为:8mol;
(3)N2(g)+3H2(g) 2NH3(g),
2NH3(g),
开始16 b 0
转化412 8
平衡12(32-12-8)8
n(始):n(平)=(16+24):((12+12+8)=40:32=5:4,故答案为:5:4;
(4)由上述解答可知,b=12+(32-12-8)=24mol,a=16mol,所以a:b=16mol:24mol=2:3,故答案为:2:3;
(5)达到平衡时,N2和H2的转化率之比a(N2):a(H2)=416:0.5=1:2,故答案为:1:2;
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,故答案为:3:3:2;
II、(1)N2(g)+3H2(g)?2NH3(g),
开始 2 6 0
开始0 0 4
在温度、体积不变的条件下,达到相同的平衡状态,则c=4mol,故答案为:4mol;
(2)①根据N2(g)+3H2(g)?2NH3(g),
开始0.7 2.1 c
转化0.5c
将c极限转化为a,即0.5c+0.7=2,解得c=2.6,故答案为:2.6;
②根据N2(g)+3H2(g)?2NH3(g),
开始2 6 0
转化x 3x 2x
平衡 2-x 6-3x 2x
2-x+6-3x+2x=7,解得x=0.5,
即平衡时物质的量分别为1.5mol、4.5mol、1mol,
当a、b、c分别为0.7、2.1、2.6时,浓度商>平衡常数(Q>K),则化学反应逆向移动,
故答案为:逆反应方向;(2分);浓度商>平衡常数;
③因平衡时c为1,c的最大值为4,则要维持反应开始向该反应方向进行,应满足1<c≤4,故答案为:1<c≤4;
(3)欲使起始反应维持向与②相反的方向进行,即反应向正向移动,平衡时b=4.5,b的最大值为6,则满足4.5<b≤6即可,
故答案为:4.5<b≤6.
本题解析:
本题难度:一般