1、选择题 在一定条件下的定容容器中,当下列物理量不再发生变化时,表明反应A(g)+2B(l) C(g)已达到平衡状态的是?(?)
C(g)已达到平衡状态的是?(?)
A.混合气体的压强
B.混合气体的密度
C.C的物质的量浓度
D.气体的总物质的量
参考答案:BC
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C正确。根据方程式可知,反应前后体积是不变的,因此气体的总物质的量和压强都是不变的,AD不正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,所以B可以说明。答案选BC。
本题难度:一般
2、选择题 将4 mol A和2 mol B放入2 L密闭容器中发生反应:2A(g)+B(g) 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是( )
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是( )
A.4 s内,v(B)=0.075 mol/(L·s)
B.当c(A)∶c(B)∶c(C)=2∶1∶2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
参考答案:A
本题解析:A项,C的浓度为0.6 mol/L,则转化的B的浓度为0.3 mol/L,故v(B)= =0.075 mol/(L·s),正确;B项,达到化学平衡状态时,c(A)∶c(B)∶c(C)不一定是2∶1∶2,故不正确;C项,因为正反应是放热反应,升高温度,平衡向逆反应方向移动,C的物质的量浓度减小,故不正确;D项,温度不变,缩小容器的体积,相当于增大压强,则化学平衡向正反应方向移动,A的转化率升高,不正确。
=0.075 mol/(L·s),正确;B项,达到化学平衡状态时,c(A)∶c(B)∶c(C)不一定是2∶1∶2,故不正确;C项,因为正反应是放热反应,升高温度,平衡向逆反应方向移动,C的物质的量浓度减小,故不正确;D项,温度不变,缩小容器的体积,相当于增大压强,则化学平衡向正反应方向移动,A的转化率升高,不正确。
本题难度:一般
3、填空题 如图所示,当关闭阀门K时,向甲中充入1.5mol A、3.5mol B,向乙中充入3mol A、7mol B,起始时,甲、乙体积均为VL。在相同温度和相同催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g)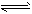 C(g)+2D(g) △H<0 达到平衡(Ⅰ)时,V(乙) =0.86V L。
C(g)+2D(g) △H<0 达到平衡(Ⅰ)时,V(乙) =0.86V L。
请回答
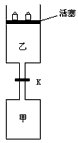
(1)乙中B的转化率为___________;
(2)甲中D和乙中C的物质的量比较:___________(填“相等”、“前者大”、 “后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为___________(用含V的代数式表示,连通管中气体体积忽略不计。)
参考答案:(1)20%
(2)后者大
(3)0.29VL
本题解析:
本题难度:一般
4、填空题 反应2A(g)+B(g)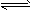 3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。求:
3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。求:
(1)A、B的转化率分别为:αA=________,αB=________。
(2)平衡混合气体的平均相对分子质量(设A的相对分子质量为MA,B的相对分子质量为MB):_______。
(3)平衡时压强与起始相比,有何变化?________(填“增大”“不变”或“减小”)。
参考答案:(1)56%;70%
(2)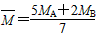
(3)不变
本题解析:
本题难度:一般
5、填空题 (12分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)?△H<0 ,试回答下列问题:
CO2(g)+H2(g)?△H<0 ,试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=? ?.
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?(填“是”与“否”),此时v(正)?v(逆)(填“大于”“小于”或“等于”),你判断的依据是?
? ?
(3)若降低温度,该反应的K值将?,该反应的化学反应速率将? ?(均填“增大”“减小”或“不变”)。
参考答案:(1)1 (2)否、大于?因为此时的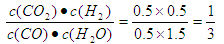 小于平衡常数1,所以正反应速率大于逆反应速率。
小于平衡常数1,所以正反应速率大于逆反应速率。
(3)增大?减小
本题解析:考查可逆反应的有关计算及外界条件对反应速率和平衡常数的影响。
(1)? CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 2? 3? 0? 0
转化的浓度(mol/L)? 1.2? 1.2? 1.2? 1.2
平衡浓度(mol/L)? 0.8? 1.8? 1.2? 1.2
根据平衡常数的表达式可知K=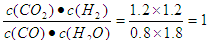
(2)? CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 1? 2? 0? 0
转化的浓度(mol/L)? 0.5? 0.5? 0.5? 0.5
某时刻浓度(mol/L)? 0.5? 1.5? 0.5? 0.5
此时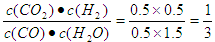 <1
<1
所以没有达到平衡状态,此时正反应速率大于逆反应速率。
(3)因为反应是放热反应,所以降低温度,平衡向正反应方向移动,因此平衡常数增大,温度反应速率减小。
本题难度:简单