1、选择题 下列关于N、Si、S、Cl等非金属元素化合物的说法正确的是?(?)
A.硝酸与金属反应时,硝酸越稀其还原产物中氮元素的价态越低
B.二氧化硅是制造太阳能电池板的主要材料
C.少量SO2与Na2O2反应的方程式为:2SO2+2Na2O2=2Na2SO3+O2
D.Ca(ClO)2比HClO稳定,所以漂白粉露置在空气中不会失效
参考答案:A
本题解析:A项由铜与浓硝酸和稀硝酸反应即可以证明;B项二氧化硅是制造光导纤维的主要材料,单质硅是制造太阳能电池板的主要材料;C项Na2O2能将SO2氧化生成Na2SO4;D项Ca(ClO)2能与空气中的水和二氧化碳反应而失效。
本题难度:简单
2、选择题 下列实验中,观察不到明显现象的是( )
A.有色布条投入干燥的氯气中
B.Cl2通入FeCl2溶液中
C.纯碱溶液滴入醋酸中
D.溴水滴加到淀粉KI溶液中
参考答案:A、氯气无漂白性,有色布条投入干燥的氯气中无变化,故A符合;
B、氯气氧化氯化亚铁为氯化铁,溶液颜色发生变化从浅绿色变化为棕黄色,故B不符合;
C、纯碱是碳酸钠和醋酸反应生成二氧化碳气体,反应过程中有气体生成,故C不符合;
D、溴水滴入淀粉碘化钾溶液中会氧化碘离子为碘单质,碘单质遇到淀粉变蓝色,故D不符合;
故选A.
本题解析:
本题难度:简单
3、填空题 亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖,油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:
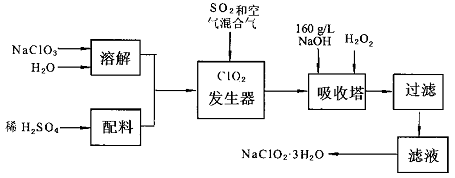
已知:①NaC1O2的溶解度随温度升高而增大,适当条件下可结晶析出NaC1O2·3H2O.
②纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
I.请根据上述流程回答下列问题
(1)发生器中鼓入空气的作用可能是?
(2)吸收塔内的反应的化学方程式为?.吸收塔的温度不能超过20℃,其目的是?.
(3)在碱性溶液中NaC1O2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是?.
(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是?.
II.上述流程中的原料NaC1O3可由氯气通入热的烧碱溶液后重结晶就得到比较纯净的产品,所以通常工厂联合氯碱车间制备.
(1)氯碱工业中的原料为?,原料需要净化的原因是?,阳极产品为?
(2)工业生产NaC1O3的化学方程式为?
参考答案:Ⅰ(1)稀释C1O2以防止爆炸;(2)2NaOH+2C1O2+H2O2=2NaC1O2+2H2O+O2?防止H2O2分解
(3)连续测定吸收塔内溶液的pH;?(4)蒸发,冷却结晶,过滤
Ⅱ.(1)饱和食盐水?防止堵塞离子交换膜?氯气?(2)3Cl2+6NaOH==5NaCl+NaClO3+3H2O
本题解析:(1)发生反应产生的C1O2不稳定易分解爆炸。鼓入空气的作用把它稀释至0%以下安全含量。(2)吸收塔内的反应的化学方程式为:2NaOH+2C1O2+H2O2=2NaC1O2+2H2O+O2。过氧化氢不稳定,高温容易分解。吸收塔的温度不能超过20℃,其目的是防止H2O2分解。(3)判断NaOH是否过量的简单实验方法是测定吸收塔内溶液的pH。(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是先将溶液蒸发水分得到NaC1O2的饱和溶液,再降低温度,利用它的溶解度随温度的升高而增大,随温度的降低而减小的特点,冷却结晶,最后过滤即得NaC1O2·3H2O。II.(1)氯碱工业中的原料为饱和食盐水原料需要净化是因为杂质容易堵塞离子交换膜。阳极产品是氯气。阴极产品是氢气和氢氧化钠。(2)工业生产NaC1O3的化学方程式为3Cl2+6NaOH==5NaCl+NaClO3+3H2O?。2)的制法、氯碱工业的原理及产品的知识。
本题难度:困难
4、选择题 1995年三位美国科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们研究揭示了大气中臭氧层被破坏的机理,由图可知(?)
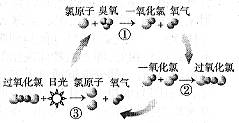
A.日光在反应中作催化剂
B.过氧化氯是一种很稳定的物质
C.过氧化氯的结构式为O-Cl-Cl-O
D.臭氧分子最终转变成氧气分子
参考答案:D
本题解析:略
本题难度:一般
5、选择题 下列有关物质的性质或应用不正确的是?
A.一定条件下,镁和铁的单质与水反应都有氢气生成
B.浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性
C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色
D.可用FeCl3溶液除去试管内壁上的难以刷去的铜迹
参考答案:C
本题解析:C项:将SO2气体通入紫色石蕊试液中,溶液变为红色,可说明二氧化硫为酸性氧化物,不能说明其漂白性,故错。故选C。
点评:本题考查的无机物的性质及化学反应,考查学生对基础知识的掌握程度,题目难度不大。
本题难度:简单