1、选择题 要配制浓度约为1mol/LNaOH溶液100mL,下列操作错误的是( )
A.在托盘天平上放两片大小、质量一样的纸,然后将氢氧化钠放在纸片上称量
B.把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶
C.用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶
D.沿玻璃棒往容量瓶中加入蒸馏水,到刻度线1-2cm时改用胶头滴管滴加,直到溶液凹液面恰好与刻度线相切
参考答案:A、称量氢氧化钠固体时应该放在小烧杯中,并且快速称量,不能直接放在托盘天平的托盘称量,否则既腐蚀托盘,又容易造成氢氧化钠潮解、变质,故A错误;
B.氢氧化钠溶于水会放热,故冷却后转移容量瓶,故B正确;
C.烧杯和玻璃棒上有沾的溶质,故要洗涤和转移操作,故C正确;
D.定容时使用胶头滴管,防止加入水过量,读数时平视,故D正确;
故选A.
本题解析:
本题难度:简单
2、选择题 在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量强碱并加热可得到cmol NH3,则原溶液中的Al3+的物质的量浓度为
[? ]
A. 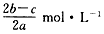
B. 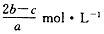
C. 
D. 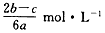
参考答案:C
本题解析:
本题难度:简单
3、简答题 某同学按下列步骤配制500mL?0.2mol?L-1 Na2SO4溶液,填空并回答有关问题.
| 实验步骤 | 有关问题
①计算所需Na2SO4的质量
需要称量Na2SO4的质量为?克
②称量Na2SO4固体
③将Na2SO4加入100ml烧杯中,并加入适量水溶解
④将烧杯中溶液移至500ml容量瓶中
为了防止溶液溅出,应采取什么措施:?
⑤向容量瓶中加蒸馏水至刻度线
在进行此操作时当水至刻度线1-2厘米处应如何操作:?
⑥摇匀
|
(1)上述实验步骤中缺一会严重影响溶液浓度的重要步骤,请简述此操作步骤:?.若不完善此步骤,所得溶液浓度?(填偏高、偏低、无影响).
(2)配制Na2SO4溶液时,下列操作情况会使结果偏高的是?.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀后,液面低于刻度线,再加水定容.
参考答案:有关问题:步骤①、配制500mL0.2mol?L-1 Na2SO4溶液,需要硫酸钠的质量为0.5L×0.2mol?L-1 ×142g/mol=14.2g;
步骤④、将烧杯中溶液移至500ml容量瓶中,为防止溶液溅出,转移中用玻璃棒引流;
步骤⑤、当水至刻度线1-2厘米处是应改用胶头滴管加水到凹液面与刻度线水平相切.
故答案为;14.2;转移中用玻璃棒引流;改用胶头滴管加水到凹液面与刻度线水平相切;
(1)实验操作的步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯和玻璃棒2~3次,并将洗涤液移入容量瓶中,继续当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加水到凹液面与刻度线水平相切,盖好瓶塞,反复颠倒上下摇匀,移入试剂瓶贴标签贮存.
故缺少的步骤为:洗涤烧杯和玻璃棒2~3次,并将洗涤液移入容量瓶中;
烧杯和玻璃棒沾有少量的硫酸钠,不洗涤,移入容量瓶内硫酸钠的实际质量减少,所配溶液的浓度偏低,
故答案为:洗涤烧杯和玻璃棒2~3次,并将洗涤液移入容量瓶中;偏低;
(2)A.溶液配制需加水定容,移液前,容量瓶中有少量蒸馏水,对所配溶液浓度无影响,故A不符合;
B.溶解搅拌时有液体飞溅,硫酸钠损失,移入容量瓶内硫酸钠的实际质量减少,所配溶液的浓度偏低,故B不符合;
C.定容时俯视容量瓶瓶颈刻度线,导致所配溶液的体积偏小,所配溶液浓度偏高,故C符合;
D.定容后,倒置容量瓶摇匀后,液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,再加水定容,所配溶液的体积偏大,所配溶液的浓度偏低,故D不符合.
故选C.
本题解析:
本题难度:一般
4、选择题 下列叙述中,正确的是( )
A.H2O的摩尔质量是18
B.等质量的O2和O3中所含的氧原子数相同
C.常温下,22.4?L?NO2中所含的氧原子数为2?NA
D.4?g?NaOH溶解于500?mL水中,所得溶液的物质的量浓度为0.2?mol?L-1
参考答案:A、H2O的摩尔质量是18g/mol,故A错误;
B、等质量的O2和O3中,氧元素质量相同,所含的氧原子数相同,故B正确;
C、常温下,22.4?L?NO2中物质的量不一定是1mol,故C错误;
D、4?g?NaOH物质的量为0.1mol,溶解于500?mL水中,溶液体积不是500ml,所得溶液的物质的量浓度小于0.2?mol?L-1,故D错误;
故选B.
本题解析:
本题难度:简单
5、简答题 实验室为确定一瓶稀盐酸的浓度,用0.100mol?L-1NaOH溶液中和50.0mL该盐酸,当酸与碱恰好完全反应时,消耗NaOH溶液100mL,试求该盐酸的物质的量浓度及溶质的质量.
参考答案:n(NaOH)=0.100L×0.1?mol?L-1=0.0100mol,
?NaOH+HCl═NaCl+H2O
? 1mol?1mol
0.0100mol?n(HCl)
n(HCl)=0.0100mol,
c(HCl)=c=nV=0.0100mol0.0500L=0.200 mol?L-1,
盐酸中溶质为HCl,则m(HCl)=0.0100mol×36.5g?mol-1=0.365g.
答:该盐酸的物质的量浓度及溶质的质量分别为0.200 mol?L-1、0.365g.
本题解析:
本题难度:一般