1、选择题 将小块生铁分别置于少量的饱和食盐水或稀醋酸溶液的试管中,一定时间后可观察到的现象是(忽略放置过程的热量变化)(?)
参考答案:AC
本题解析:A正确,生铁发生吸氧腐蚀,导致试管内气体压强减少,U形管形成左高右低;B错,在稀醋酸溶液中,生铁发生析氢腐蚀,导致试管内气体压强增大,U形管形成左低右高;C正确;D错,生铁发生吸氧腐蚀,导致试管内气体压强减少,U形管形成左高右低;
本题难度:一般
2、选择题 下列说法正确的是
A.钢铁发生电化腐蚀的正极反应式:Fe-2e-="=" Fe2+[来
B.为实现铁上镀铜,可让铁做阳极.
C.粗铜精炼时,与电源正极相连的是纯铜
D.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-==Cl2↑
参考答案:D
本题解析:A错,钢铁发生电化腐蚀的负极反应式:Fe-2e-="=" Fe2+;B错,为实现铁上镀铜,可让铁做阴极;C错,粗铜精炼时,与电源正极相连的是粗铜;D正确;
本题难度:一般
3、选择题 下列金属防腐的措施中,属于使用电化学保护法的是
A.在铁中加入铬、镍等制成不锈钢
B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块
参考答案:D
本题解析:D.地下钢管连接镁块,形成原电池,钢管做正极,被保护。
本题难度:一般
4、简答题 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁锈蚀的影响因素,某同学做了如下探究实验:
序号 | 内容 | 实验现象
1
常温下将铁丝放在干燥空气中一个月
干燥的铁丝表面依然光亮
2
常温下将铁丝放在潮湿空气中一小时
铁丝表面依然光亮
3
常温下将铁丝放在潮湿的空气中一个月
铁丝表面已变得灰暗
4
将潮湿的铁丝放在高于常温的空气中一小时
铁丝表面已变得灰暗
5
将浸过氯化钠溶液的铁丝放在高于常温的空气中一小时
铁丝表面灰暗程度比实验4严重
|
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)______;在电化学腐蚀中,负极反应是______;
(2)由该实验可知,可以影响铁锈蚀速率的因素是______.
(3)为防止铁的锈蚀,工业上普遍采用的方法是______(答两种方法).
参考答案:(1)3、4、5中铁丝表面发生了变化,说明铁丝发生了电化学腐蚀;铁丝发生电化学腐蚀中,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+.
故答案为:3﹑4﹑5;Fe-2e-=Fe2+;?
(2)2、4实验说明温度影响铁的腐蚀;1、3实验说明湿度影响铁的腐蚀;4、5实验说明电解质的存在影响铁的腐蚀,所以影响铁腐蚀的因素有:温度、湿度和电解质的存在,
故答案为:温度﹑湿度﹑电解质的存在;
(3)为发生铁发生,常用的方法有:电镀﹑刷漆等表面覆盖法及牺牲阳极保护阴极法等,
故答案为:电镀﹑刷漆等表面覆盖法及牺牲阳极保护阴极法等.
本题解析:
本题难度:一般
5、选择题 利用如图装置可以模拟铁的电化学防护。下列叙述正确的是? ( )。
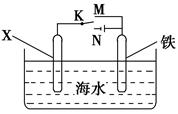
A.铁被腐蚀过程实质是金属铁发生了还原反应
B.若X为锌片,开关K置于M处,可减缓铁的腐蚀
C.若X为碳棒,开关K置于M处,可减缓铁的腐蚀
D.当K置于N处时,可减缓铁的腐蚀
参考答案:B
本题解析:铁被腐蚀是铁发生了氧化反应,A错误;当X为锌,K置于M处时,构成原电池,铁作正极被保护,B正确;当X为碳棒,K置于M处时,仍构成原电池,铁作负极,加快了金属的腐蚀,C错误;当K置于N处时,构成电解池,铁作阳极,加快了金属的腐蚀,D错误。
本题难度:一般