1、选择题 下列叙述中,不正确的是:
A.工业上电解饱和食盐水的阳极反应: 
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应: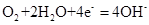
D.电解池中的阳极和原电池中的负极上都发生还原反应
参考答案:D
本题解析:
答案:D
D.不正确,电解池中的阳极和原电池中的负极上都失电子,发生氧化反应
A、正确,阳极还原性物质失电子。
B、正确,锌比铁活泼,与电解质形成原电池时,作负极,保护船体不被腐蚀;
C、正确,正确极得电子。
本题难度:简单
2、选择题 为了防止轮船船体的腐蚀,应在船壳水线以下位置嵌下一定数
[? ]
A.铜块
B.铅块
C.锌块
D.钠块
参考答案:C
本题解析:
本题难度:简单
3、实验题 (15分)已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下图:
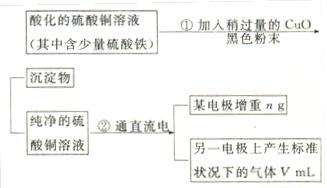
回答下列问题:
(1)加入CuO的作用是?。
(2)步骤②中所用的部分仪器如图所示,则A、B分别连直流电源的?和?极(填“正”或“负”)。

(3)电解开始后,在U形管中可以观察到的现象有:?。A极发生的电极反应式为?。
B极发生的电极反应式为_____________________________________。
(4)下列实验操作中必要的是?(填写字母) 。
。
(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为?(用带有n、V的式子表示)。
参考答案:
(1)通过消耗H+而调整溶液的pH使之升高,其目的是使Fe3+完成水解形成Fe(OH)3沉淀而除去(2分)
(2)负;正(各1分)
(3)石墨上有气泡逸出,溶液颜色变浅(2分)
2Cu2++4e-===2Cu↓(2分)
4OH――4e- ==O2↑+2H2O(2分)
(4)A、B、D、E(3分。全对给3分,只答2个或3个且正确的给2分,只答1个且正确的给1分。只要选择C,该空就为0分)
(5)11200n/ V?(2分)
本题解析:略
本题难度:简单
4、选择题 如图所示:甲为稀硫酸,乙为氯化铜溶液,电极材料用元素符号表示,则下列说法中正确的是
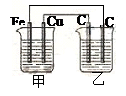
A.甲装置将电能转变为化学能
B.乙装置中左边的碳棒上有红色金属析出
C.甲中Cu为阳极
D.甲中Fe的质量少了0.56g,乙中右边的碳棒质量增加了0.64g
参考答案:D
本题解析:铁和稀硫酸反应生成氢气,则根据装置图可知,甲是原电池,乙是电解池,A不正确。甲中铁是负极,铜是正极。所以乙装置中左边的碳棒是阳极,溶液中的氯离子放电,生成氯气,B不正确;C不正确,D正确,0.56g铁是0.01mol,失去0.02mol,则根据电子的得失守恒可知,乙中右边的碳棒析出铜的物质的量是0.01mol,质量是0.64g,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
5、选择题 a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块如图所示放置一段时间。下列有关描述错误的是
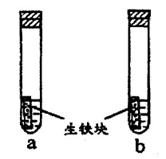
A.生铁块中的碳是原电池的正极
B.a试管内压强变大,b试管内压强变小
C.两试管中相同的电极反应式是:2Fe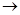 Fe2++2e-
Fe2++2e-
D.两试管中均发生了电化腐蚀
参考答案:B
本题解析:A、a、b两试管都是惰性电极C作原电池的正极,正确;B、a试管电解质溶液是NaCl溶液,发生吸氧腐蚀,气体的量减少,则压强变小,b试管电解质溶液是NH4Cl溶液,NH4+水解生成H+,发生析氢腐蚀,气体的量增多,压强变大,错误;C、两试管负极都是Fe,发生电极反应相同:Fe-2e?=Fe2+,正确;D、两试管都形成了原电池,发生了电化学腐蚀,正确。
本题难度:一般