1、选择题 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间有无因果关系的判断都正确的是
选项
| 陈述Ⅰ
| 陈述Ⅱ
| 判断
|
A
| 用锌和足量稀硫酸制取氢气时加入硫酸铜溶液
| 可以制取更多的氢气
| Ⅰ对、Ⅱ对、有
|
B
| 用Mg—Al—NaOH构成原电池
| Mg更活泼作负极
| Ⅰ对、Ⅱ对、无
|
C
| AlCl3是离子化合物
| 电解熔融的AlCl3制取金属铝
| Ⅰ对、Ⅱ对、无
|
D
| 石墨常用做电解池的电极
| 石墨的化学性质稳定且导电性好
| Ⅰ对、Ⅱ对、有
参考答案:D
本题解析:A中陈述Ⅰ用锌和足量稀硫酸制取氢气时加入硫酸铜溶液,是形成锌铜原电池,加快反应速率,但是制取的氢气会减少,因为其中一部分锌用来置换出铜,所以Ⅰ对、Ⅱ错、两者间无因果关系;B中陈述Ⅰ用Mg—Al—NaOH构成原电池由于镁不能和氢氧化钠反应,铝可以,所以镁做正极;所以Ⅰ对、Ⅱ错、两者间无因果关系;C中陈述ⅠAlCl3是离子化合物本身就是错误的,因为它是共价化合物,所以也无法电解熔融的氯化铝,所以Ⅰ错、Ⅱ错、两者间无因果关系;D中陈述Ⅰ石墨常用做电解池的电极,陈述Ⅱ石墨的化学性质稳定且导电性好,所以Ⅰ对、Ⅱ对、两者间有因果关系。故选D。
点评:本题考查的是原电池的应用。学生要熟练掌握原电池的基本知识,这类问题便可解决。原电池是将化学能直接转化为电能的一种装置。其原理也是通过化学反应(在正负极发生不同的氧化还原反应)使闭合电路中产生电子流,从而产生电流的。其中在负极发生氧化反应,正极发生还原反应。
本题难度:一般
2、选择题
A.2H++2e- H2 H2
B.2H2O+O2+4e- 4OH- 4OH-
C.Fe-2e- Fe2+ Fe2+
D.4OH--4e- 2H2O+O2 2H2O+O2
参考答案:C
本题解析:钢铁发生电化学腐蚀时,铁作负极被氧化,电极方程式为:Fe-2e-===Fe2+。
本题难度:简单
3、选择题 下列说法正确的是?( )。
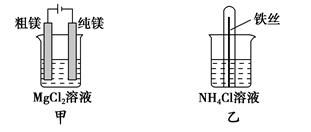
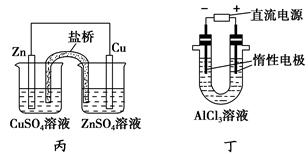
A.用甲装置电解精炼镁
B.用乙装置验证试管中铁丝发生析氢腐蚀
C.用丙装置构成铜锌原电池
D.用丁装置利用电冶金法制铝
参考答案:B
本题解析:Mg2+和Al3+在溶液中不放电,选项A和D错。丙装置中两种电解液互换才能构成铜锌原电池,C错。
本题难度:一般
4、选择题 [双选题]为了避免青铜器生成铜绿,以下方法正确的是( )
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗透的高分子膜
参考答案:BD
本题解析:Cu比Ag活泼,形成的原电池中Cu作负极,A不正确;将青铜器放在潮湿的空气中,在表面形成原电池,Cu被腐蚀,C不正确。
本题难度:一般
5、选择题 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O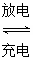 3Zn(OH)2+2Fe(OH)3+4KOH。关于该电池的说法正确的是( ) 3Zn(OH)2+2Fe(OH)3+4KOH。关于该电池的说法正确的是( )
A.放电时,Zn作负极,发生还原反应
B.放电时,K2FeO4附近溶液pH减小
C.充电时,锌极附近溶液pH减小
D.充电时,阳极电极反应为:
|
Fe(OH)3-3e-+5OH-=FeO +4H2O
+4H2O
参考答案:D
本题解析:放电时,Zn作负极,发生氧化反应,正极反应为:FeO +3e-+4H2O=Fe(OH)3+5OH-,溶液pH增大;充电时,锌极反应为Zn(OH)2+2e-=Zn+2OH-,溶液pH增大。
+3e-+4H2O=Fe(OH)3+5OH-,溶液pH增大;充电时,锌极反应为Zn(OH)2+2e-=Zn+2OH-,溶液pH增大。
本题难度:一般