1、选择题 下列说法正确的是( )
A.甲烷、汽油、生物柴油、酒精都是碳氢化合物,都可作燃料
B.可食用植物油含有的高级脂肪酸甘油酯是人体的营养物质
C.钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高
D.用CuSO4溶液使蛋清溶液发生盐析,进而提纯分离蛋白质
参考答案:A.酒精含有碳氢氧元素,不属于碳氢化合物,故A错误;
B.高级脂肪酸甘油酯是人体的营养物质,故B正确;
C.铁在海水中易腐蚀的原因是因为海水中含有大量的电解质,形成了无数微小的原电池造成的,不是因为海水中含氧量高造成的,故C错误;
D.硫酸铜是重金属盐,能使蛋白质发生变性,变性是不可逆过程,故D错误.
故选B.
本题解析:
本题难度:简单
2、填空题 (16分)(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲装置的名称是____________ (填“原电池”或“电解池”)。
(2) 写出电极反应式: Pt极______? _ ;当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________________;
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
(Ⅱ)燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置。对于以强碱为电解质的CH4燃料电池,负极电极反应式为:?
随着放电的进行,溶液的pH?(填“变大”“变小”或“不变”)
(Ⅲ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铜电极、铂电极进行电解实验。
(1)要使电解过程中溶质的组成和质量不变,而该稀溶液的浓度增大,又无浑浊,应以?______为阳极电解________?溶液,阳极电极反应式为____________________________?。
(2)以铂作阳极电解 ________?溶液时,溶液的碱性有明显增强,且溶液保澄清,电解的总反应式为 __________________________?。
参考答案:(Ⅰ)(1)原电池?(1分)?(2)2Cl-- 2e-=?Cl2↑(2分)? 6.4g (2分)
(3)无变化(1分)
(Ⅱ)CH4+10OH--8e=CO32-+7H2O (2分)?变小(1分)
(Ⅲ)(1)?铂(1分)? Na2SO4(1分)
4OH--4e- = 2H2O+O2↑(2分)(写2H2O-4e- = O2↑+4H+ 同样给分)?
(2)? NaCl(1分)? 2NaCl+2H2O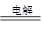 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
(没写“电解”或“通电”不给分)
本题解析:(Ⅰ)(1)甲装置轴锌和稀硫酸可以发生置换反应,所以甲是原电池,乙是电解池。
(2)锌比铜活泼,所以锌是负极,铜是正极,则Pt是阳极,溶液中的氯离子在阳极失去电子,生成氯气,反应式为2Cl-- 2e-=?Cl2↑。甲中产生的气体是氢气,物质的量是0.1mol,转移电子是0.2mol,所以根据电子的得失守恒可知,乙中析出铜的物质的量是0.2mol÷2=0.1mol,其质量为6.4g。
(3)都换成铜电极,则阳极铜失去电子,同时阴极铜离子又得到电子而析出,所以溶液的浓度是不变的,即溶液的颜色无变化。
(Ⅱ)甲烷在反应中失去电子,所以在负极通入。又因为溶液显碱性,所以负极电极反应式为CH4+10OH--8e-=CO32-+7H2O。氧气得到电子,在正极通入,电极反应式为2O2+8e-+4H2O=8OH-,所以总反应式为CH4+2O2+2OH-=CO32-+3H2O,所以溶液的pH是减小的。
(Ⅲ)(1) )要使电解过程中溶质的组成和质量不变,则电解的是水,所以电解的是硫酸钠。阳极是OH-放电,反应式为4OH--4e- = 2H2O+O2↑。
(2)溶液的碱性有明显增强,且溶液保澄清,所以电解的是氯化钠溶液,反应式为
2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
本题难度:一般
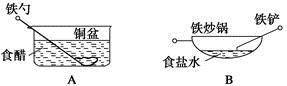
3、选择题 相同材质的铁在图中四种情况下最不易被腐蚀的是

参考答案:C
本题解析:在A中,能构成原电池,铁作负极,易被腐蚀;在B中,食盐水提供电解质溶液环境,铁炒锅和铁铲都是铁碳合金,符合原电池形成的条件,铁作负极,碳作正极,铁易被腐蚀;在C中,铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀;在D中,酸雨提供电解质溶液环境,铁铆钉和铜板分别作负、正极,形成原电池,铁易被腐蚀。答案选C。
本题难度:一般
4、选择题 下列装置的线路接通后,经过一段时间,溶液的pH明显下降的是()
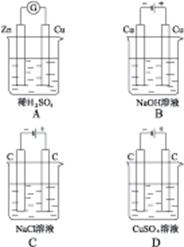
参考答案:D
本题解析:A为原电池,反应式为:Zn+H2SO4 ZnSO4+H2↑,c(H+)下降,pH上升。B、C、D均为电解池,反应式依次为:Cu+2H2O
ZnSO4+H2↑,c(H+)下降,pH上升。B、C、D均为电解池,反应式依次为:Cu+2H2O Cu(OH)2↓+H2↑、2NaCl+2H2O
Cu(OH)2↓+H2↑、2NaCl+2H2O 2NaOH+H2↑+Cl2↑、2CuSO4+2H2O
2NaOH+H2↑+Cl2↑、2CuSO4+2H2O 2Cu+2H2SO4+O2↑,则B中水减少,c(NaOH)上升、c(OH)-上升、pH上升;C中产生NaOH、pH上升;D中产生H2SO4,pH下降。故选择D选项。
2Cu+2H2SO4+O2↑,则B中水减少,c(NaOH)上升、c(OH)-上升、pH上升;C中产生NaOH、pH上升;D中产生H2SO4,pH下降。故选择D选项。
本题难度:简单
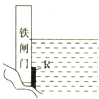
5、选择题 为了降低某水库的铁闸门被腐蚀的速率,可以采取如图所示的方案,其中焊接在铁闸门上的固体材料R可以采用( )
A.铜
B.钠
C.锌
D.石墨