| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《水的电离平衡》练习题(四)
参考答案:A 本题解析:根据电荷守恒可知,2c(SO42-)+c(OH-)=c(NH4+)+c(H+)。所以如果溶液中c(NH4+)=2c(SO42-)时,c(OH-)=c(H+),即溶液显中性,答案选A。 本题难度:一般 2、填空题 (1)将该温度下a mL pH="13" NaOH溶液与b mL0.05mol/L H2SO4混合,所得混合溶液的pH=7, |
参考答案:(1) 1(2) C (3) 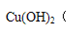
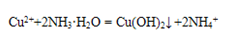
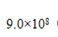
本题解析:(1)由题意可知氢离子浓度等于氢氧根离子浓度,而氢氧根离子浓度由离子离子积常数10-14除以10-13等于0.1故氢氧根离子的物质的量为0.1a 氢离子物质的量为0.05乘以2乘以b 等于0.1b所以a:b =1 (2)C选项会抑制AgCl的电离,且氯化铝中氯的浓度最大,所以答案选C。(3)由题目可知氢氧化铜的溶解平衡常数最小,所以先生成氢氧化铜 ,
考点:考查离子平衡移动及溶解平衡的相关知识
本题难度:一般
3、实验题 (15分)草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
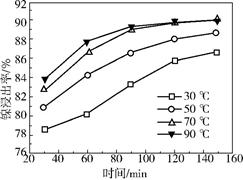
参考答案:(1)增大接触面积,加快反应速率;提高镍的浸出率
(2)C
(3)静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成
(4)①洗去(NH4)2SO4杂质、便于烘干
②防止温度过高,草酸镍晶体失去结晶水或分解
(5)①第1步:(加适量H2SO4溶液,)加足量H2O2溶液,充分反应后用NaOH溶液调节溶液5.0≤pH<6.7;第3步:用NaOH溶液调节“溶液X”的pH≥9.5
②除去杂质Ca2+或CaSO4
本题解析:(1)粉碎的目的是增大接触面积,使反应速率加快,同时提高镍的浸出率;
(2)由图中数据可知,当温度在70-90℃时,时间在120-150min时镍的浸出率最高,从节约能源的角度分析,应该选择70℃,120min,故选择c;
(3)要证明沉镍工序中Ni2+已经沉淀完全,只需将溶液静置,取上层清夜,在上层清夜中,滴加草酸铵溶液,观察有无沉淀生成,若无沉淀,说明已经沉淀完全;
(4)①用乙醇清洗的目的是便于洗涤,便于烘干;
②加入氟化铵的目的是防止温度过高而使草酸镍晶体失水或者分解;
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,加入适量硫酸和过量的双氧水,使二价铁完全转化为三价铁,再用氢氧化钠溶液调节pH,使Al3+和Fe3+完全沉淀,充分反应后过滤,以除去铁、铝元素; 第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;第3步: 用NaOH溶液调节“溶液X”的pH,充分反应后过滤; 第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。其中第2步加入适量NH4F溶液的作用是除去Ca2+或者硫酸钙。
考点:物质的分离和提纯,实验的评价
本题难度:困难
4、选择题 下列叙述正确的是:
A.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
B.依据相对分子质量,一定能判断组成和结构相似的物质熔沸点的高低
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
参考答案:A
本题解析:
本题难度:简单
5、选择题 下列物质分别加入水后对水的电离程度的影响都不同的一组是( )
| A | NaCl | HF | HCl B H2SO4 CaCO3 SO2 C KHSO4 HI Hg D Ba(OH)2 KCl Na2CO3 |
参考答案:D
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《食品添加剂.. | |