1、选择题 现有三组混合液:(1)乙酸乙酯和乙酸钠溶液;(2)乙醇和甲醇;(3)溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依此是
[? ]
A.分液、蒸馏、萃取
B.萃取、分液、蒸馏
C.萃取、蒸馏、分液
D.分液、萃取、蒸馏
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列实验操作正确的是( )
A.过滤时,用玻璃棒搅拌以加速过滤
B.蒸馏时,冷凝水应从冷凝管上口进,下口出
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.用酒精萃取碘水中的碘
参考答案:C
本题解析:
本题难度:一般
3、填空题 草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图:回答下列问题:
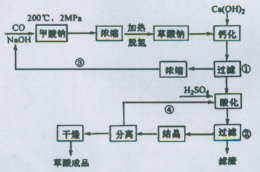
(1)CO和NaOH在一定条件下合成甲酸钠,甲酸钠加热脱氢的化学反应方程式分别为:____、____?。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是?,滤渣是____?;过滤操作②的滤液是?和?,滤渣是____?。
(3)工艺过程中③和④的目的是____?。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是___?。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMn04溶液滴定,至浅粉红色不消褪,消耗KMn04溶液15.00 mL,反应的离子方程式为____?;
列式计算该成品的纯度?。
参考答案:

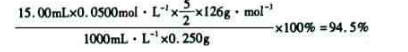
本题解析:⑴CO和NaOH在一定条件下合成甲酸钠的反应可用观察法将其配平;甲酸钠加热脱氢(产生H2),通过观察法并结合原子守恒得另一生成物为Na2C2O4。
⑵根据“钙化”反应:Na2C2O4+Ca(OH)2=CaC2O4↓+2NaOH,由此可确定过滤操作①的滤液是NaOH,滤渣是CaC2O4;根据“酸化”反应:CaC2O4+H2SO4=CaSO4+ H2C2O4,由此可确定过滤操作②的滤液是H2C2O4,滤渣是CaSO4;
⑶该工艺过程中③和④(“回头”)分别循环利用氢氧化钠和硫酸,减小污染,也可降低成本。
⑷若在甲酸钠脱氢后生成的Na2C2O4中直接用硫酸酸化制备草酸,会产生Na2SO4杂质。
⑸根据得失电子守恒有5C2O42-+2MnO4-――2Mn2++10CO2↑,再根据电荷守恒有5C2O42-+2MnO4-+16H+――2Mn2++10CO2↑,最后根据原子守恒得5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;最后根据该反应方程式建立关系式“5(H2C2O4·2H2O)~2KMnO4”,得该成品的纯度为:
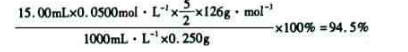 。
。
本题难度:一般
4、选择题 下列说法正确的是
A.摩尔是表示物质粒子数量的单位
B.物质的量可理解为物质的质量
C.摩尔是表示物质的量的单位
D.摩尔是七个基本物理量之一
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列实验操作中错误的是(?)
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处
C.用某已知浓度的浓盐酸配制500mL 0.1mol/L的稀盐酸,应选用的仪器有胶头滴管、烧杯、玻璃棒、量筒、500mL容量瓶
D.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
参考答案:D
本题解析:蒸发操作时,当蒸发皿中出现大量晶体时,即可以停止加热,利用余热就可以完全蒸发,所以选项D是不正确的,其余选项都是正确的,答案选D。
本题难度:一般