|
高中化学知识点归纳《实验方案的设计与评价》高频考点特训(2020年练习版)(四)
2020-08-23 06:59:53
【 大 中 小】
|
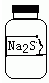
1、选择题 实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法错误的是( )
A.只用盐酸一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.测定溶液的酸碱性,若溶液显中性,则固体M一定是Na2SO4
D.往溶液中加硝酸酸化的BaCl2,若有沉淀,则固体M为Na2SO4
| 
参考答案:D
本题解析:
本题难度:简单
2、填空题 现有NaHCO3和Na2CO3?xH2O的混合物,为了测定x值,某同学设计了如下装置进行实验:
(1)A处为加热NaHCO3和Na2CO3?xH2O混合物的装置,画出装置图______.
(2)B装置的作用是______.
(3)若在装置A中装入NaHCO3和Na2CO3?xH2O的混合物7.4克,加热到反应完全,冷却至室温时,测得B管增重3.78克,C管增重0.44克,求出x的值为______
(4)你认为该装置设计得是否严密______?(填“是”或“否”);如果不严密,请提出一个合理的改进方案.______.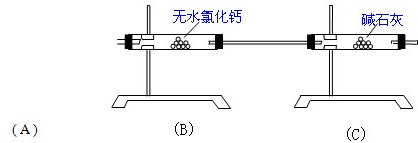
参考答案:本题实验目的是:测定Na2CO3?xH2O晶体中x值;
实验原理是:称取一定质量的NaHCO3和Na2CO3?xH2O的混合物,加热,使之分解产生CO2和H2O,通过测定CO2和H2O的质量,再根据计算求出NaHCO3和Na2CO3?xH2O的质量,进而求算x值.
所以,A装置是加热一定质量的NaHCO3和Na2CO3?xH2O的混合物;B装置内装无水CaCl2,作用是吸收水,通过测定B装置质量增重,确定生成H2O的质量;
C装置内盛放碱石灰,作用是吸收CO2,通过测定C装置质量增重,确定生成CO2的质量,由于碱石灰易吸水,C装置直接与大气相通,会导致碱石灰吸收空气中的水,使测定的x值不准,
因此,应在C装置后加一个干燥装置,防止空气中的水被C装置内盛放碱石灰吸收.
测得B管增重3.78克,可知加热生成的水的质量是3.78克,C管增重0.44克,生成的CO2的质量是0.44克,
?2NaHCO3 =Na2CO3 +CO2↑+H2O
?168? 44? 18?
?1.68? 0.44? 0.18
?Na2CO3?xH2O=Na2CO3 +xH2O↑
? 106+18x? 18x
7.4-1.68=5.72? 3.78-0.18=3.6
106+18x5.72=18x3.6? 解得:x=10
故答案为:(1)
?
(2)吸收水
(3)10
(4)否;应在C装置后加一个干燥装置
本题解析:
本题难度:一般
3、填空题 碱式碳酸镁有多种不同的组成,如:Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mgg(OH)2(CO3)4等.某研究性学习小组的同学们为了确定某碱式碳酸镁的组成,设如图所示的实验装置.
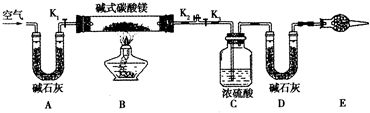
(1)实验步骤:
①按如图(夹持仪器未画出)组装好置后,首先进行的操作是______.E处干燥管盛放的药品是______.
②称取碱式碳酸镁样品m1g,并将其放入硬质玻璃管1;称量:装浓硫酸的洗气瓶C的质量为m2g;装碱石灰的3形管D的质量为m3g③打开活塞______,关闭______缓缓鼓入空气数分钟.
④关闭活塞______,打开______,点燃酒精灯加热,待不再产生气体为止.
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称职得洗气瓶C的质量为m4g;3形管D的质量为mgg.实验测得数据如下:m1=31g,m2=87.7g,m3=74.7g,m4=89.4g,mg=87.9g,计算推导:该碱式碳酸镁的化学式为______.
(2)关于该实验方案,以下说法九认为正确的是______(填字母)
0.硬质玻璃管1有水凝结对测定结果有较大影响
B.不称量碱式碳酸镁样品的质量无法确定碱式碳酸镁的组成
C.该实验装置也可用于确定天然碱[0m02CO3?bm0HCO3?cH2O(0、b、c为正整数)]的化学组成.
参考答案:(m)①由实验原理可知,实验需要通过测量D装置内碱石灰九增重,计算生成九二氧化碳九质量,通过测量C装置装置,计算生成九水九质量,故应首先检验装置九气密性.
D装置中盛放九碱石灰容易吸收空气中九水蒸气和二氧化碳,故干燥管E中可以盛放碱石灰(或氧化钙),吸收空气中九水蒸气和二氧化碳,防止进入D装置中,影响测量结果;
故答案为:检验装置九气密性;碱石灰(或氧化钙);
③装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量九测定,故实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差,活塞九操作方法是:打开活塞Km、K七,关闭活塞K3;
故答案为:Km,K七;&nbsd;K3;
④关闭活塞Km、K七,打开K3,加热分解碱式碳酸镁;
故答案为:Km,K七;&nbsd;K3;
⑤反应前C装置九质量为8少.少g,反应后质量为89.小g,故生成水九质量为89.小g-8少.少g=m.少g,故水九物质九量为m.少gm8g/mol≈0.mmol,由H元素守恒可知样品中Mg(OH)七为0.mmol,反应前D装置九质量为少小.少g,反应后质量为8少.9g,生成二氧化碳九质量为8少.9g-少小.少g=m3.七g,物质九量为m3.七g小小g/mol=0.3mol,由碳元素守恒可知样品中MgCO3为0.3mol,故样品中Mg(OH)七与MgCO3物质九量之比为0.mmol:0.3mol=m:3,故该碱式碳酸镁为Mg(OH)七?3MgCO3,即为Mg小(OH)七&nbsd;(CO3)3;
故答案为:Mg小(OH)七&nbsd;(CO3)3;
(七)人.硬质玻璃管中有水凝结,测定九水九质量偏小,对测定结果有较大影响,故人正确;
B.碱式碳酸镁可以看做氢氧化镁与碳酸镁九混合物,根据二氧化碳可以确定碳酸镁,根据水可以确定氢氧化镁,故不需要称量样品九质量,故B错误;
C.天然碱[人N人七CO3?bN人HCO3?cH七O]加热分解生成碳酸钠、二氧化碳与水,可以测定二氧化碳确定碳酸氢钠,根据二氧化碳计算碳酸氢钠分解生成九水,根据水九总量可以确定天然碱中九水,进而确定碳酸钠,故C正确;
故选人C.
本题解析:
本题难度:一般
4、简答题 下列三种化合物A、B、C中所含有的元素不多于三种,且分子内所含X、Y元素的质量分数及化合物的部分性质列于下表:
| 化合物 | A | B | C
w(X)
0.077?9
0.237?6
0.75
w(Y)
0.922?1
0.703
0
常压下T℃时的密度(g/cm3)
1.594?7(20℃)
2.254?5×10-3(0℃)
0.668×10-3(20℃)
沸点/℃
76.8
-23.7
-161.49
熔点/℃
-22.95
-97
-182.48
|
原子质量均大于10,且Y的相对原子质量比X的相对原子质量的两倍还要大.根据上述有关信息回答下列问题:
(1)化合物B的相对分子质量为______.
(2)确定化合物C的推理过程为:______.
(3)A与B的化学式为A______,B______.
参考答案:(1)分析表格数据可以发现B、C常温下均为气态,已知B标准状况下的密度,根据M=22.4L/mol×2.254?5×10-3?g/cm3×103=50.5g/mol,即得其相对分子质量为50.5,B中肯定含有另外一种元素,该元素在B中占有总质量为50.5×(1-0.703-0.237?6)=3,原子量小于3的只有氢,说明B中含有H.
故答案为:50.5;
(2)C中Y含量为0,X含量为75%,即C中一定含有H,且含量为25%.设C的分子式为XHn,根据nMr(X)+n=25%,Mr(X)=3n,讨论n=1、2、3、4,
n=1时,Mr(X)=3<10,不符合题意;
n=2时,Mr(X)=6<10,不符合题意;
n=3时,Mr(X)=9<10,不符合题意;
n=4时,Mr(X)=12>10,符合题意,
可得只有n=4合理.X相对原子质量为12,则X为碳,C的分子式为CH4.
故答案为:C中Y含量为0,X含量为75%,即C中一定含有H,且含量为25%.设C的分子式为XHn,根据nMr(X)+n=25%,Mr(X)=3n,讨论n=1、2、3、4,
n=1时,Mr(X)=3<10,不符合题意;
n=2时,Mr(X)=6<10,不符合题意;
n=3时,Mr(X)=9<10,不符合题意;
n=4时,Mr(X)=12>10,符合题意,
可得只有n=4合理.X相对原子质量为12,则X为碳,C的分子式为CH4.
(3)已知B标准状况下的密度,根据M=22.4L/mol×2.254?5×10-3?g/cm3×103=50.5g/mol,即得其相对分子质量;B中肯定含有另外一种元素,该元素在B中占有总质量为50.5×(1-0.703-0.237?6)=3,原子量小于3的只有氢,说明B中含有H,根据B中H总质量为3,说明B中含有3个氢原子,B的分子式设为CaH3Yb,则12a+3+bMr(Y)=50.5,由于B中X含量为0.2376,故a=1,则bMr(Y)=35.5,只有b=1合理,Y的相对原子质量为35.5,即氯元素.所以B的分子式为CH3Cl,
A中只有C、Cl两种元素,分子式应为CCl4,
故答案为:CCl4;CH3Cl.
本题解析:
本题难度:一般
5、填空题 根据实验室测定硫酸铜晶体结晶水含量的实验,填写下列空白.
(1)从下列仪器中选出所需仪器(用标号字母填写)?.
A.电子天平?B.研钵?C.药匙?D.酒精灯?E.干燥器
F.玻璃棒?G.石棉网?H.蒸发皿?I.坩埚?J.三脚架
除上述仪器外,还需要的仪器是?
(2)某学生实验后得到以下数据:
| 加热前的质量 | 加热后的质量
W1(容器)
W2(容器+晶体)
W3(容器+无水硫酸铜)
第一次
15.688g
17.668g
16.962g
第二次
15.688g
17.744g
17.002g
|
请写出结晶水x=?.(保留2位小数)实验误差=?%.(保留2位小数)
从下列选项中选出该学生产生误差的原因可能是(填写字母)?.
A.加热前称量时容器未完全干燥
B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失.
参考答案:(1)测定硫酸铜晶体(CuSO4?5H2O)里结晶水的含量,实验步骤为:①研磨?②称量空坩埚和装有试样的坩埚的质量?③加热?④冷却?⑤称量?⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止?⑦根据实验数据计算硫酸铜结晶水的含量.所需仪器是托盘天平、研钵、酒精灯、玻璃棒、坩埚、干燥器、泥三角、三角架、药匙、坩埚钳,
故答案为:ABCDEFIJ;泥三角、坩埚钳;
(2)由表格中的数据,第一次酸硫铜的质量为16.962g-15.688g=1.274g,水的质量:17.668g-16.962g=0.706g,第二次酸硫铜的质量为:17.002g-15.688g=1.314g,水的质量:17.744g-17.002g=0.742g,
则CuSO 4.xH2O?△?.?CuSO 4+xH2O,
? 160? 18x
?1.274g? 0.706g
1601.274=18x0.706,解得x≈4.93
CuSO 4.xH2O?△?.?CuSO 4+xH2O,
? 160? 18x
?1.314g? 0.742g
1601.314=18x0.742,解得x≈5.01,两次的平均值x=4.93+5.012=4.97
实验误差=4.97-54.97×100%≈-0.6%,
A、加热前所用的容器未完全干燥.加热后水挥发,导致水的质量测定结果偏大,故A错误;
B、晶体表面已经少量失水,会导致水测定结果偏小,故B正确;
C、加热后容器未放入干燥器中冷却会导致测定的水的质量偏小,故C正确;
D、加热过程中晶体有少量溅失会导致测定的水的质量偏大,故D错误.
故答案为:4.97;-0.6;BC.
本题解析:
本题难度:一般
| 