1、填空题 (1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为________。
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________。
(3)陶瓷、玻璃、水泥的组成中的共同成分是______________。
参考答案:(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O?
(2)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO?
(3)硅酸盐
本题解析:
本题难度:一般
2、选择题 如图,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象;当打开B阀后,C处红布条逐渐褪色。则D瓶中装的是
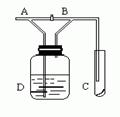 ?
?
A.浓盐酸
B.NaOH溶液
C.H2O
D.饱和NaCl溶液
参考答案:B
本题解析:题意表明D瓶中的物质能与Cl2反应,满足的是B、C,但氯气溶于水的比例为1:2,故还是会有少量氯气通到C中。2的化学性质。
点评:此题考核了氯气的水溶液具有漂白性的性质。
本题难度:简单
3、选择题 据报导,在全国各地发生过多次因混合洁污剂引起氯气中毒的事件。据此推测相混合的洁污剂中最有可能含
A.ClO4-、Cl-、Na+
B.ClO-、Cl-、H+
C.NaClO、NaClO3
D.NaClO、NaCl
参考答案:B
本题解析:略
本题难度:一般
4、选择题 在100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( )
A.0.15 mol·L-1
B.0.225 mol·L-1
C.0.35 mol·L-1
D.0.45 mol·L-1
参考答案:B
本题解析:先分别计算出n(H+)=0.06 mol,n(NO)=0.04 mol,n(Cu)=0.03 mol;再根据离子方程式:3Cu+2NO+8H+===3Cu2++2NO↑+4H2O可知,n(NO)和n(Cu)过量,n(H+)的量不足,根据n(H+)和上述离子方程式计算出生成的n(Cu2+)即可。
本题难度:一般
5、填空题 氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2+H2O?H++Cl-+HClO,其平衡常数表达式为K=________。
(2)工业上常用熟石灰和氯气反应制取漂白粉,反应的化学方程式是____________________________。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入,这样加料的目的是__________________________。处理从氯化塔中逸出气体的方法是________。
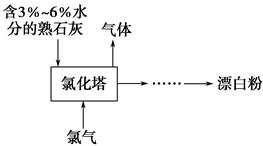
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是____________________________________,其原因可能是__________________,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
参考答案:(1)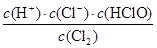
(2)2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O 充分接触(或充分吸收) 用碱液吸收(或石灰乳或碱石灰或氢氧化钠溶液等)
(3)6OH-+3Cl2=5Cl-+ClO3-+3H2O 反应放热使温度升高所致
本题解析:(1)水作为溶剂(纯液体)不写入平衡常数表达式。(2)熟石灰从塔顶喷入,气体从下往上,类似于硫酸工业中SO3的吸收,这样能增大液、气的接触面积,以吸收充分。没有吸收的氯气从氯化塔中逸出,氯气的处理需要用碱性溶液吸收。(3)有KClO3生成,说明0价的氯被氧化到+5价,则一定有0价的氯化合价降低,推知为KCl,然后根据电子守恒逆向配平。一段时间后KClO3增多,则可能是KOH与氯气反应放热,使温度升高,造成了副反应增加。
本题难度:一般