1、选择题 Li- Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++ FeS +2e-=Li2S+Fe 有关该电池的下列说法中,正确的是
[? ]
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为:Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+ Fe-2e-=2Li++FeS
参考答案:B
本题解析:
本题难度:一般
2、填空题 (14分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有杂质Fe2O3。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示。
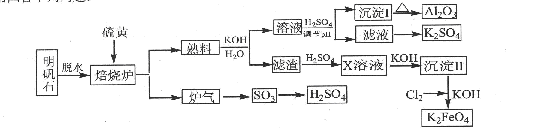
请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4) 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
(2)生成沉淀I的离子方程式为 ,沉淀II的化学式为 。
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是 。
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: 。
(5)从滤液中得到K2SO4晶体的方法是 。
(6) K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的
阳极反应式: .
参考答案:(每空2分,共14分)
(1)3.612×1024或6NA
(2)AlO2-+H++H2O=Al(OH)3↓ Fe(OH)3
(3)取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若无色白色沉淀生成,则已洗干净。
(4)2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
(5)蒸发结晶
(6)Fe+8OH--6e-=FeO42-+4H2O
本题解析:(1)102gAl2O3的物质的量是1mol,即生成1molAl2O3时也生成3mol的二氧化硫,硫酸根离子中S元素的化合价为+6价,二氧化硫中的S元素的化合价为+4价,所以生成3mol的二氧化硫转移电子的物质的量是6mol,即3.612×1024或6NA;
(2)沉淀I是氢氧化铝沉淀,明矾石经过脱水、焙烧、与氢氧化钾溶液反应后得到的溶液中含有偏铝酸根离子,加入硫酸生成氢氧化铝沉淀,离子方程式为AlO2-+H++H2O=Al(OH)3↓ 沉淀II与氯气、氢氧化钾溶液反应生成高铁酸钾,所以沉淀II的化学式为 Fe(OH)3;
(3)氢氧化铝是偏铝酸钾溶液与硫酸溶液反应的产物,所以氢氧化铝沉淀中可能含有硫酸根离子,证明沉淀是否洗涤干净即证明洗涤液中是否含有硫酸根离子,证明方法是取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若无色白色沉淀生成,则已洗干净。
(4)沉淀II与氯气、氢氧化钾溶液反应生成高铁酸钾,铁元素化合价升高,氯元素的化合价降低成为氯离子,化学方程式为2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O;
(5)从硫酸钾溶液中得到硫酸钾晶体的方法是蒸发结晶
(6)以铁为电极,电解浓的KOH溶液来制取K2FeO4,阳极发生氧化反应,K2FeO4中铁元素的化合价为+6价,所以铁失6个电子与氢氧根离子结合生成FeO42-,电极反应式为Fe+8OH--6e-=FeO42-+4H2O。
考点:考查氧化还原反应的计算,对反应流程图的分析,化学方程式的判断及书写,电化学原理的应用
本题难度:困难
3、选择题 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中不正确的是(?)

A.x是正极,y是负极
B.x是负极,y是正极
C.a极和Pt都有气泡产生
D.U形管中溶液的碱性增强
参考答案:A
本题解析:根据装置特点可知属于电解池,b极附近溶液呈蓝色,说明该极有单质碘生成,即I-离子失去电子,被氧化,所以该电极是阳极,则y是电源的正极,x是负极,c是阴极,Cu2+放电析出铜。Pt是阳极,OH-放电生成氧气。a是阴极,H+放电,放出氢气。所以答案是A。
本题难度:一般
4、选择题 随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。下列有关说法中不正确的是

[? ]
A.电解法合成氨的电解池中能用水作电解质溶液的溶剂
B.钯电极A的电极反应式为:N2+6e-+6H+==2NH3
C.钯电极B连接的是电源的正极
D.当有0.3mol电子转移时,有0.12mol?NH3生成
参考答案:A
本题解析:
本题难度:一般
5、填空题 某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,对该溶液以惰性电极进行电解,分阶段写出电解反应的化学方程式.
第一阶段的反应:______;
第二阶段的反应:______.
参考答案:某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,溶液中含有的阳离子的放电顺序为:Cu2+>H+>Mg2+,阴离子的放电顺序为:Cl->OH->NO3-,所以第一阶段放电的离子为Cu2+和Cl-,第二阶段放电的离子为H+和OH-,所以电解反应的 化学方程式第一阶段的反应:CuCl2通电.Cu+Cl2↑;第二阶段的反应:2H2O通电.2H2↑+O2↑;
故答案为:CuCl2通电.Cu+Cl2↑;2H2O通电.2H2↑+O2↑.
本题解析:
本题难度:简单